当前位置:首页 > 高等教育 > 工学 > 华北理工环境监测课件第4讲-原子吸收分光光度法
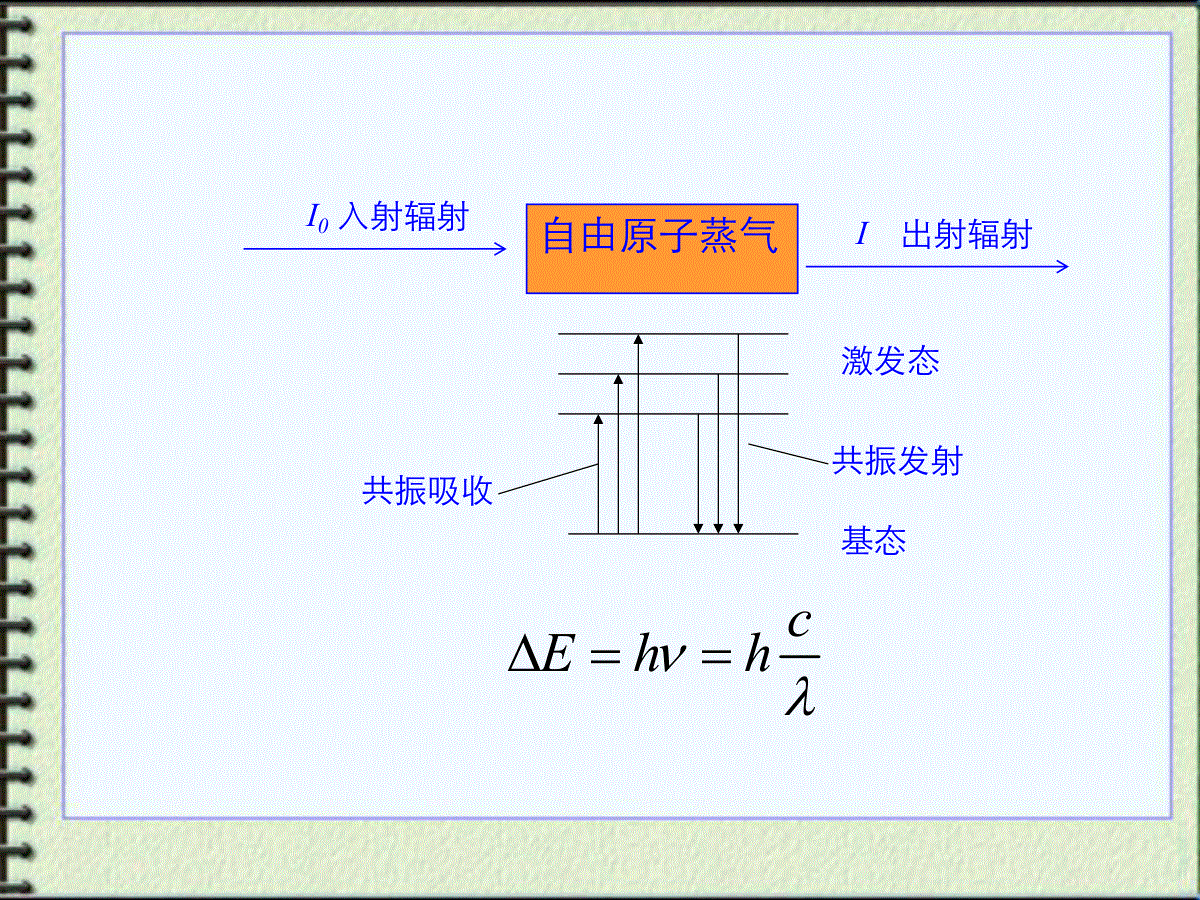
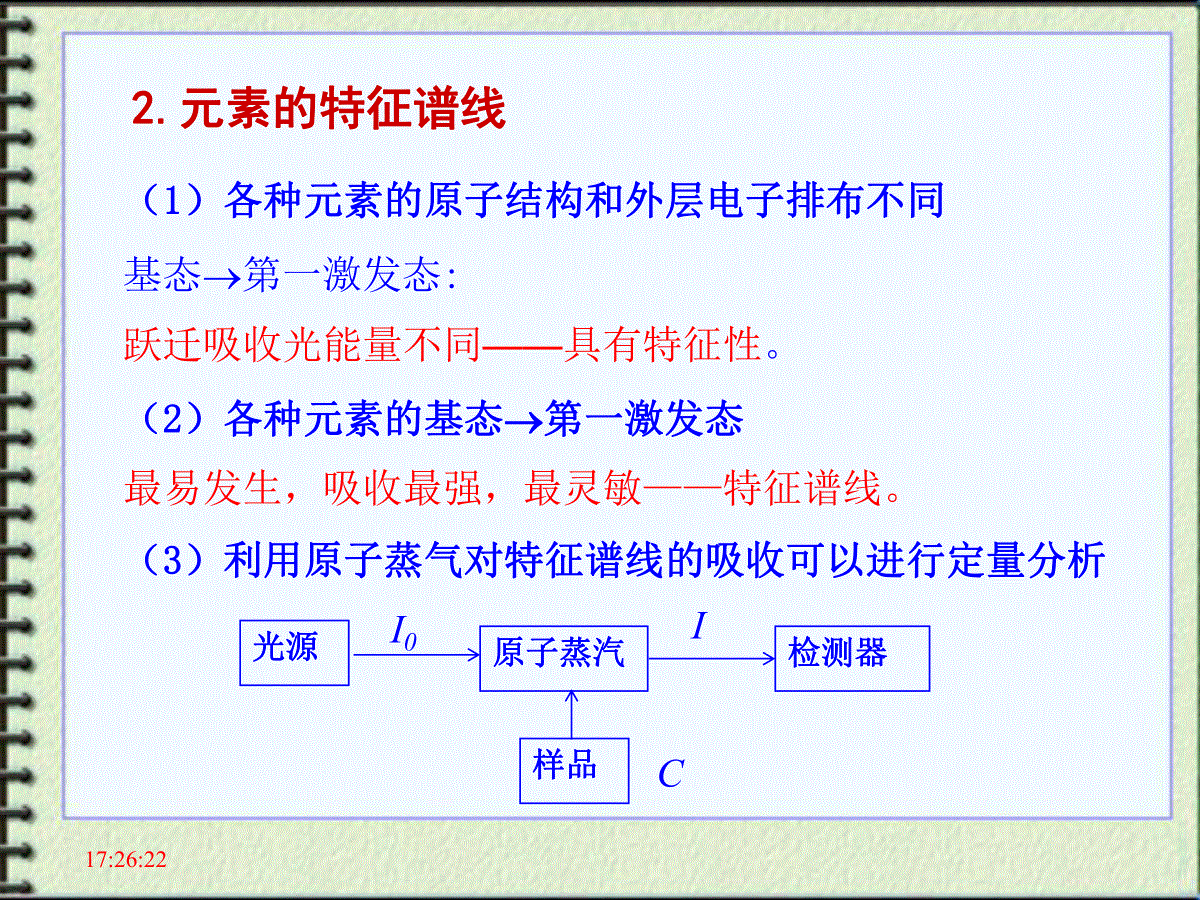
原子吸收分光光度法17:26:22一、概述原子吸收:1802年发现原子蒸气对其原子共振辐射吸收的现象;1955年后原子吸收光谱法迅速发展。特点:(1)检出限低,10-10~10-14g;(2)准确度高,1%~5%;(3)选择性高,一般情况下共存元素不干扰;(4)应用广,可测定70多个元素(各种样品中);局限性:难熔元素、非金属元素测定困难、不能同时多元素。17:26:22二、原子吸收光谱的产生1.原子的能级与跃迁基态第一激发态,吸收一定频率的辐射能量。产生共振吸收线(简称共振线)吸收光谱激发态基态发射出一定频率的辐射。产生共振发射线(也简称共振线)发射光谱基态激发态共振吸收共振发射cEhh自由原子蒸气I0入射辐射I出射辐射17:26:222.元素的特征谱线(1)各种元素的原子结构和外层电子排布不同基态第一激发态:跃迁吸收光能量不同——具有特征性。(2)各种元素的基态第一激发态最易发生,吸收最强,最灵敏——特征谱线。(3)利用原子蒸气对特征谱线的吸收可以进行定量分析光源原子蒸汽检测器样品I0IC17:26:22理论:线状光谱吸收线。实际:峰形吸收(具有一定宽度)表征吸收线轮廓(峰)的参数:中心频率O(峰值频率):最大吸收系数对应的频率;中心波长:λ(nm)半宽度:Δ0约10-3nm17:26:22吸收峰变宽原因:(1)自然宽度(2)温度变宽(多普勒变宽)(3)压力变宽(4)自吸变宽(5)场致变宽17:26:22钨丝灯光源和氘灯,经分光后,光谱通带宽0.2nm。而原子吸收线半宽度:10-3nm。如图:用一般光源照射时,吸收光的强度变化仅为0.5%。灵敏度极差。0.0001nm难题通常光栅可分开0.1nm,要分开0.01nm的两束光需要很昂贵的光栅;要分开两束波长相差0.0001nm的光,目前技术难以实现;此外,即使光栅满足了要求,分出的光也太弱,难以用于实际测量。17:26:23锐线光源锐线光源需要满足的条件:(1)光源的发射线与吸收线的ν0一致。(2)发射线的Δν1/2小于吸收线的Δν1/2。空心阴极灯提供锐线光源的方法:17:26:23五、基态原子数与原子化温度需要考虑:待测元素原子蒸气中基态原子~原子总数的定量关系。17:26:23激发态原子数Nj与基态原子数N0之比较小,1%。可用基态原子数代表待测元素的原子总数。六、定量基础A=kN0bN0∝N∝c(N0激发态原子数,N基态原子数,c待测元素浓度) 所以:A=lg(IO/I)=K'c17:26:23原子吸收仪器(1)空心阴极灯火焰棱镜光电管17:26:23七、原子吸收光谱仪主要部件原子吸收分光光度计与紫外可见分光光度计在仪器结构上的不同点:(1)采用锐线光源。(2)分光系统在火焰与检测器之间。17:26:231.流程17:26:232.光源作用:提供待测元素的特征谱线。获得较高的灵敏度和准确度。要求:(1)能发射待测元素的共振线;(2)能发射锐线;(3)辐射光强度大,稳定性好。空心阴极灯结构:17:26:23空心阴极灯工作原理•适当电压下,电子从空心阴极内壁流向阳极;•电子与惰性气体碰撞,电离产生正电荷,在电场作用下,向阴极内壁猛烈轰击;•阴极表面金属原子溅射出来,再与电子、惰性气体原子及离子发生撞碰而被激发,阴极内形成辉光(阴极物质和内充惰性气体的光谱);•用不同待测元素作阴极材料,可制成相应空心阴极灯。•空心阴极灯的辐射强度与灯的工作电流有关。优、缺点:(1)辐射光强度大,稳定,谱线窄,灯容易更换。(2)每测一种元素需更换相应的灯。17:26:233.原子化系统作用:将试样中离子转变成原子蒸气。原子化方法:火焰原子化法无火焰原子化法—电热高温石墨管。低温原子化-测汞等。高温无火焰17:26:23主要缺点:雾化效率低。火焰原子化系统:雾化器、雾化室和燃烧器.作用:产生大量基态自由原子,并能保持原子化期间基态原子浓度恒定。雾化器结构:如图所示17:26:23火焰作用:雾滴经蒸发,干燥,离解(还原)等过程,产生大量基态原子。火焰温度的选择:(1)保证待测元素充分离解的前提下,尽量用低温火焰;(2)火焰温度越高,产生的热激发态原子越多;(3)火焰温度取决于燃气与助燃气类型,常用空气—乙炔,最高温度2600K。火焰类型:化学计量火焰:温度高,干扰少,稳定,背景低,常用。富燃火焰:还原性火焰,燃烧不完全,测定较易形成难熔氧化物的元素Mo、Cr、稀土等。贫燃火焰:火焰温度低,氧化性气氛,适用于碱金属测定预混合火焰结构17:26:24八、石墨炉原子化装置(1)结构:外气路:Ar气沿石墨管外壁流动,冷却保护石墨管;内气路:Ar气由管两端流向管中心,从中心孔流出,用来保护原子不被氧化,同时排除干燥和灰化过程中产生的蒸汽。缺点:精密度差,测定速度慢,操作不简便,装置复杂。用电热代替火焰;组成:电源、保护气系统、石墨管炉17:26:24(2)原子化过程试样:溶液(1~50μL)或固体(几mg)从进样孔加到石墨管中,程序升温四阶段:干燥、灰化、原子化和高温除残。17:26:24原子化过程l干燥除去溶剂和水温度:稍高于溶剂的沸点,水溶液在105℃。干燥时间:一般每μL试液需约1.5秒。l灰化除去易挥发的基体和有机物。灰化温度及时间:通过实验选择,通常100~1800℃,0.5~1分钟。l原子化使试样解离为中性原子。随被测元素不同,需选择最佳的原子化温度和时间。温度2500~3000℃,时间3~10秒。原子化过程中,停止Ar气通过,以延长原子在石墨炉管中的平均停留时间。l除残也称净化。测定结束后,提高温度,除去石墨管中的残留物,净化石墨管,减少因样品残留所产生的记忆效应。温度:高于原子化温度10%左右;除残时间:通过选择而定。17:26:24(3)石墨炉原子化器的特点优点:●灵敏度高,检测限低。温度较高,原子化效率高;管内原子蒸气不被载气稀释,在吸收区域中平均停留时间长;经干燥、灰化,起到分离、富集作用;●原子化温度高。可用于较难挥发和原子化的元素的分析。惰性气体气氛,对易形成难解离氧化物的元素分析更有利;●进样量少。溶液:1~50μL,固体:仅几mg。缺点:●精密度较差。管内温度不均匀,进样量、进样位置的变化,引起管内原子浓度的不均匀等因素所致;●基体效应、化学干扰较严重,有记忆效应,背景较强;●仪器装置较复杂,价格较贵,需要水冷。17:26:24火焰原子化法与石墨炉原子化法比较平顶形尖峰状方法原子化热源原子化温度原子化效率进样体积讯号形状检出限重现性基体效应火焰化学火焰能相对较低(一般3000℃)较低(30%)较多(约1mL)高Cd:0.5ng/mLAl:20ng/mL较好RSD为0.5~1%较小石墨炉电热能相对较高(可达3000℃)高(90%)较少(1~50μL)低Cd:0.002ng/mLAl:1.0ng/mL较差RSD为1.5~5%较大17:26:24九、低温原子化法又称化学原子化法,原子化温度为室温~几百℃。⑴汞低温原子化法--化学法将试样中的[Hg]还原为Hg0,由载气(Ar、N2、air)将汞Hg(g)送入气体吸收池。⑵氢化物原子化法适用Ge、Sn、Pb、As、Sb、Bi、Se及Te等。原理:化学法将被测元素还原成氢化物(如AsH3、SnH4、BiH3)。用载气送入石英管,氢化物热分解成原子,测A。特点:检测限比火焰法低1~3数量级,选择性好,干扰少。17:26:24十、定量方法(1)标准曲线法制备待测物的标准溶液系列浓度:0,c1,c2,c3,c4……cx吸光度:A0,A1,A2,A3,A4……Ax以Ai-A0对浓度C做图得一直线,图中cX点即待测溶液浓度。ACAxCx教材以蒸馏水为空白;也可选择其它空白。原子吸收法一般不作工作曲线标准曲线和工作曲线有什么区别?17:26:24(2)标准加入法(见本章镉的测定,此处略)适于:组成复杂,基体影响较大,得不到纯净的基体空白。方法:1.四个容量瓶+等体积试样。2.加0、1、2、4体积的标样3.定容4.测定A5.绘制A~C标准曲线6.外延曲线与横坐标相交,Cx即为试样中待测元素的含量。



 三七文档所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。
三七文档所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。
本文标题:华北理工环境监测课件第4讲-原子吸收分光光度法
链接地址:https://www.777doc.com/doc-10677145 .html