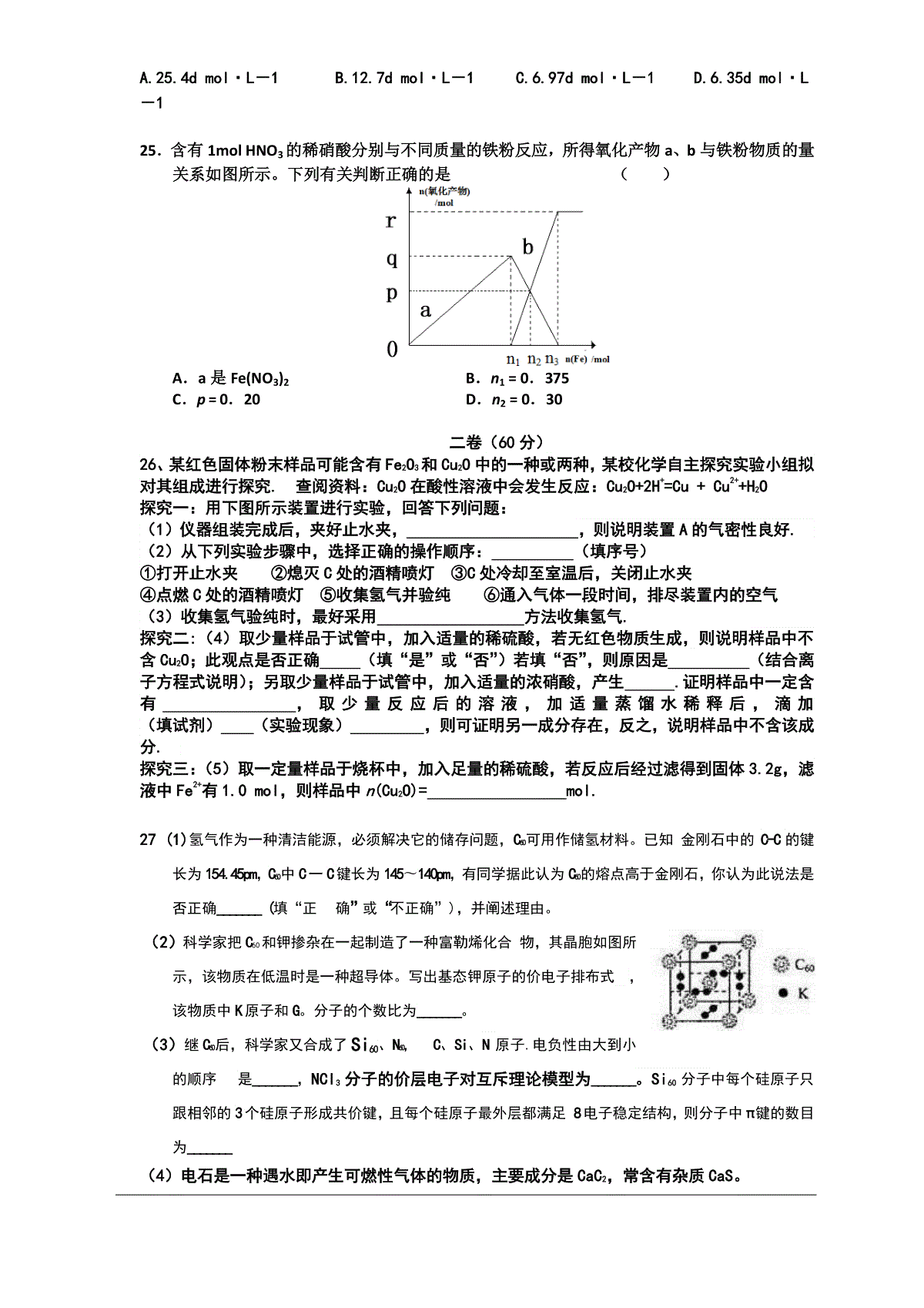
高三年级化学试题可能用到的相对原子质量:H:1C:12N:14O:16Na:23Mg:24P:31S:32Cl:35.5Ca:40Fe:56Cu:64Zn:65Ba:137Ag:108Ⅰ卷(选择题共40分)一、选择题(共25题,1-10每小题1分,11-25每小题2分,每题只有一个....正确选项)1、X、Y是周期表前20号元素,已知X、Y之间原子序数相差3,X、Y能形成化合物M。不正确A.若X、Y处于同一周期,则化合物M可能是正四面体型分子晶体B.若X的单质常温下是气体,则Y的单质常温下不可能是气体C.若X、Y两元素周期数差1,则属于离子化合物的M有四种D.若M属于离子晶体,则其中可能含有非极性键2.amol金属单质M和含2.5amolHNO3的稀溶液恰好完全反应,氧化产物是M(NO3)2,则还原产物可能是A.NO2B.NOC.N2O5D.NH4NO33.将充有mmolNO和nmolNO2气体的试管倒立于水槽中,然后通入mmolO2,若已知n>m,则充分反应后,试管中的气体在同温同压下的体积为A.(4n-1)/2B.(n-m)/3C.(3m+n)/3D.3(n-m)4.奥运会会标是五环旗,假定奥运五环旗中的每一环或每种颜色表示一种物质,相连的环(物质)间一定条件下能发生常见反应,不相连的环(物质)间不能发生反应,且四种反应中必须包含化合反应、置换反应及复分解反应,适合的一组是5.现有两种短周期主族元素X,Y,且在常温下X的单质呈气态,Y的单质呈固态.则推断不正确的是A.若X,Y位于工A族,则X,Y可能与氧元素形成原子个数比为1:1或2:1的化合物B.若X,Y位于第兰周期,则X,Y形成的化合物可能是离子化合物或共价化合物C.若气态H,X的沸点高于H-Y,则X,Y只能位于周期表可A族D.若X,Y位于周期表的同一周期,则最高价含氧酸的酸性可能是6.下图装置(I)为一种可充电电池的示意图,其中的离子交换膜只允许K+通过,该电池充放电的化学方程式为;,装置(II)为电解池的示意图当闭合开关K时,X附近溶液先变红。则下列说法正确的是A.闭合K时,K十从左到右通过离子交换膜B.闭合K时,A的电极反应式为:3I――2e-=I2-C.闭合K时,X的电极反应式为:2CI-一2e-=Cl2个D.闭合K时,当有0.1mo1K+通过离子交换膜,X电极上产生标准状况下气体2.24L7.同温同压下,对于等体积的一氧化氮(14N18O)和一氧化碳(13C18O)气体,下列说法正确的是:A.含相同的分子数和原子数B.含相同的分子数和电子数C.含相同的质子和中子数D.所含分子数和质量均不相同8.NA代表阿伏加德罗常数,下列叙述错误的是A.10mL质量分数为98%的H2SO4,用水稀释至100mL,H2SO4的质量分数为9.8%B.在H2O2+Cl2=2HCl+O2反应中,每生成32g氧气,则转移2NA个电子C.标准状况下,分子数为NA的CO、C2H4混合气体体积约为22.4L,质量为28gD.一定温度下,1L0.5mol·L-1NH4Cl溶液与2L0.25mol·L-1NH4Cl溶液含NH4+物质的量不同9.常温下,向20升真空容器中通入a摩尔H2S和b摩尔Cl2(a和b都是正整数,且均小于或等于5),反应完全后,容器内气体可能达到的最大密度是A.19.45克/升B.18.25克/升C.17.85克/升D.35.5克/升10.25℃时,某硫酸铜溶液的质量分数为w,物质的量浓度为cmol/L,密度为ρg/mL,将此溶液蒸去ag水或再向原溶液中加入bg无水硫酸铜粉末,充分静置并恢复至25℃时,均恰好全部转化为CuSO4·5H2O晶体。则下列关系式正确的是A.160wcB.4cwC.ba916D.ba16911、化合物A、B、C、D各由两种元素组成,甲、乙、丙是前两周期元素的三种单质。这些常见的化合物与单质之间存在如下关系(已知化合物C是一种有机物),以下结论不正确的是A.上图所示的五个转化关系中,有三个是化合反应B.上述转化关系所涉及的化合物中有一种是电解质C.甲、乙、丙三种单质的晶体均是分子晶体D.上图所示的五个转化关系中,均为氧化还原反应12.向1mol炽热的Cu2S通入足量的水蒸气,充分反应后生成2molH2,则Cu2S应转化为A.Cu和SO2B.Cu和SC.CuO和SO2D.Cu2O和S13.将两种硫酸盐按一定比例混合后共熔,可制得化合物X,X溶于水能电离出K+、Cr3+、SO42-,若将2.83gX中的Cr3+全部氧化为Cr2O72-后,溶液中的Cr2O72-可和过量KI溶液反应,得到3.81gI2,反应的离子方程式为:Cr2O72-+6I-+14H+=2Cr3++3I2+7H2O,若向溶有2.83gX的溶液中,加入过量的BaCl2溶液,可得到4.66g白色沉淀。由此推断出X化学式为A.K2SO4·2Cr2(SO4)3B.2K2SO4·Cr2(SO4)3C.K2SO4·Cr2(SO4)3D.K2SO4·1/2Cr2(SO4)314.短周期元素X、Y、Z的原子序数依次递增,其原子的最外层电子数之和为13。X与Y、Z位于相邻周期,Z原子最外层电子数是X原子内层电子数的3倍,是Y原子最外层电子数的3倍。下列说法正确的是()A.X的氢化物溶于水显酸性B.Y的氧化物是离子化合物C.Z的氢化物比H2O稳定D.X和Z的氧化物对应的水化物都是强酸15.磷酸氢二铵[(NH4)2HPO4]可用作复合肥料。关于该物质的下列说法不正确...的是()A.HPO42-中含有共价键,其中P的化合价为+5价B.是一种离子化合物,其中铵根离子的电子式为C.该化合物中所有原子均满足8电子稳定结构D.其中P元素的质量分数比N元素的质量分数高16.设NA为阿伏加德罗常数,下列叙述正确的是()①lmolCH3CH2C(CH3)3所含甲基个数为4NA②2.8g乙烯和2.8g聚乙烯中含碳原子数均为0.2NA③1.0L1.0mol/LCH3COOH溶液中,CH3COOH分子数为NA④8.8g乙酸乙酯中含共用电子对数为1.4NA⑤标准状况下,22.4L乙醇完全燃烧后生成CO2的分子数为2NA⑥常温常压下,17g甲基(一14CH3)所含的中子数为9NA⑦标准状况下,11.2L氯仿中含有C—Cl键的数目为1.5NA⑧lmolC15H32分子中含碳碳键数目为14NAA.①③⑤⑦B.①②④⑧C.②③⑥⑧D.①②⑥⑧17.下列叙述中,正确的是()A.两种微粒,若核外电子排布完全相同,则其化学性质一定相同B.凡单原子形成的离子,一定具有稀有气体元素原子的核外电子排布C.晶体中只要有阳离子就会有阴离子D.电子数相同的阳离子和阴离子一定不具有相同的质子数18.电子层数相同的短周期元素X、Y、Z、W,其中X的最外层电子数比K层少1,Y的最外层电子数比K层多l,Z的单质是一种半导体材料,常用于制造太阳能电池,W的原子半径是同周期中最小的。下列推断中正确的是()A.Z的氢化物的热稳定性强于w的氢化物B.Z的氧化物与水反应可制得相应的含氧酸C.X、Y、W的原子半径依次减小,对应的离子半径依次增大D.X、Y、W的最高价氧化物对应水化物之间互相都能发生反应19.在一种酸性溶液中存在NO3-、I-、Cl-、Fe3+中的一种或几种离子,向该溶液中加入溴水,溴单质被还原,由此可推知该溶液中()A.一定含有I-,不能确定是否含有Cl-B.一定含有NO3-C.不含有Fe3+,可能含有NO3-D.一定含有I-、NO3-和Cl-20.将质量为W1g的钠、铝混合物投入一定量的水中充分反应,金属没有剩余,溶液澄清,共收集到标准状况下的气体V1L。向溶液中逐滴加入浓度为amol/L的盐酸,过程中有白色沉淀生成后又逐渐溶解,当沉淀恰好消失时所加盐酸体积为V2L,将溶液在HCl气氛中小心蒸干得固体W2g。下列所列关系式中正确的是()A.35.5a=(W2-W1)V2B.n(Al)150WmolC.n(Na)+3n(Al)=1222.4VmolD.aV2=122.4V21.往100mLpH=0的硫酸和硝酸混合液中投入3.84g铜粉,微热使反应充分完成后,生成一氧化氮气体448mL(标准状况)。则反应前的混合溶液中含硝酸的物质的量为()A.0.02molB.0.08mlC.0.10molD.0.16mol22.将质量分数为2w,物质的量浓度为c1的乙醇溶液加水稀释,使质量分数变为w,物质的量浓度变为c2,则c1和c2之间关系正确的是()A.c12c2B.c2=2c1C.c2c12c2D.c1=2c223.已知A、B为单质,C为化合物。能实现上述转化关系的是()①若C溶于水后得到强碱溶液,则A可能是Na②若C的溶液遇Na2CO3,放出CO2气体,则A可能是O2③若C的溶液中滴加KSCN溶液显红色,则B可能为Cl2④若C的溶液中滴加NaOH溶液有蓝色沉淀生成,则B可能为Cl2A.①②④B.②④C.①③④D.③④24.向密度为dg·cm-3的盐酸中逐滴加入硝酸银溶液到过量,生成沉淀的质量与原盐酸的质量相等,原盐酸的物质的量浓度为()A.25.4dmol·L-1B.12.7dmol·L-1C.6.97dmol·L-1D.6.35dmol·L-125.含有1molHNO3的稀硝酸分别与不同质量的铁粉反应,所得氧化产物a、b与铁粉物质的量关系如图所示。下列有关判断正确的是()A.a是Fe(NO3)2B.n1=0.375C.p=0.20D.n2=0.30二卷(60分)26、某红色固体粉末样品可能含有Fe2O3和Cu2O中的一种或两种,某校化学自主探究实验小组拟对其组成进行探究.查阅资料:Cu2O在酸性溶液中会发生反应:Cu2O+2H+=Cu+Cu2++H2O探究一:用下图所示装置进行实验,回答下列问题:(1)仪器组装完成后,夹好止水夹,,则说明装置A的气密性良好.(2)从下列实验步骤中,选择正确的操作顺序:(填序号)①打开止水夹②熄灭C处的酒精喷灯③C处冷却至室温后,关闭止水夹④点燃C处的酒精喷灯⑤收集氢气并验纯⑥通入气体一段时间,排尽装置内的空气(3)收集氢气验纯时,最好采用方法收集氢气.探究二:(4)取少量样品于试管中,加入适量的稀硫酸,若无红色物质生成,则说明样品中不含Cu2O;此观点是否正确(填“是”或“否”)若填“否”,则原因是(结合离子方程式说明);另取少量样品于试管中,加入适量的浓硝酸,产生.证明样品中一定含有,取少量反应后的溶液,加适量蒸馏水稀释后,滴加(填试剂)(实验现象),则可证明另一成分存在,反之,说明样品中不含该成分.探究三:(5)取一定量样品于烧杯中,加入足量的稀硫酸,若反应后经过滤得到固体3.2g,滤液中Fe2+有1.0mol,则样品中n(Cu2O)=mol.27(1)氢气作为一种清洁能源,必须解决它的储存问题,C60可用作储氢材料。已知金刚石中的C-C的键长为154.45pm,C60中C一C键长为145〜140pm,有同学据此认为C60的熔点高于金刚石,你认为此说法是否正确_______(填“正确”或“不正确”),并阐述理由。(2)科学家把C60和钾掺杂在一起制造了一种富勒烯化合物,其晶胞如图所示,该物质在低温时是一种超导体。写出基态钾原子的价电子排布式,该物质中K原子和G。分子的个数比为_______。(3)继C60后,科学家又合成了Si60、N60,C、Si、N原子.电负性由大到小的顺序是_______,NCl3分子的价层电子对互斥理论模型为_______。Si60分子中每个硅原子只跟相邻的3个硅原子形成共价键,且每个硅原子最外层都满足8电子稳定结构,则分子中π键的数目为_______(4)电石是一种遇水即产生可燃性气体的物质,主要成分是CaC2,常含有杂质CaS。①CaC2中所含化学键类型是________________阴离子电子式为________________②写出CaC2与盐酸反应的化学方程式______________________(5)Mg2Si遇水会产生自燃性气体,64g该自燃性




 三七文档所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。
三七文档所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。
本文标题:高三上学期化学试题
链接地址:https://www.777doc.com/doc-1932992 .html