当前位置:首页 > 商业/管理/HR > 质量控制/管理 > 2013_年杭州市第一次高考科目教学质量检测化学试卷及答案(答案更正版)
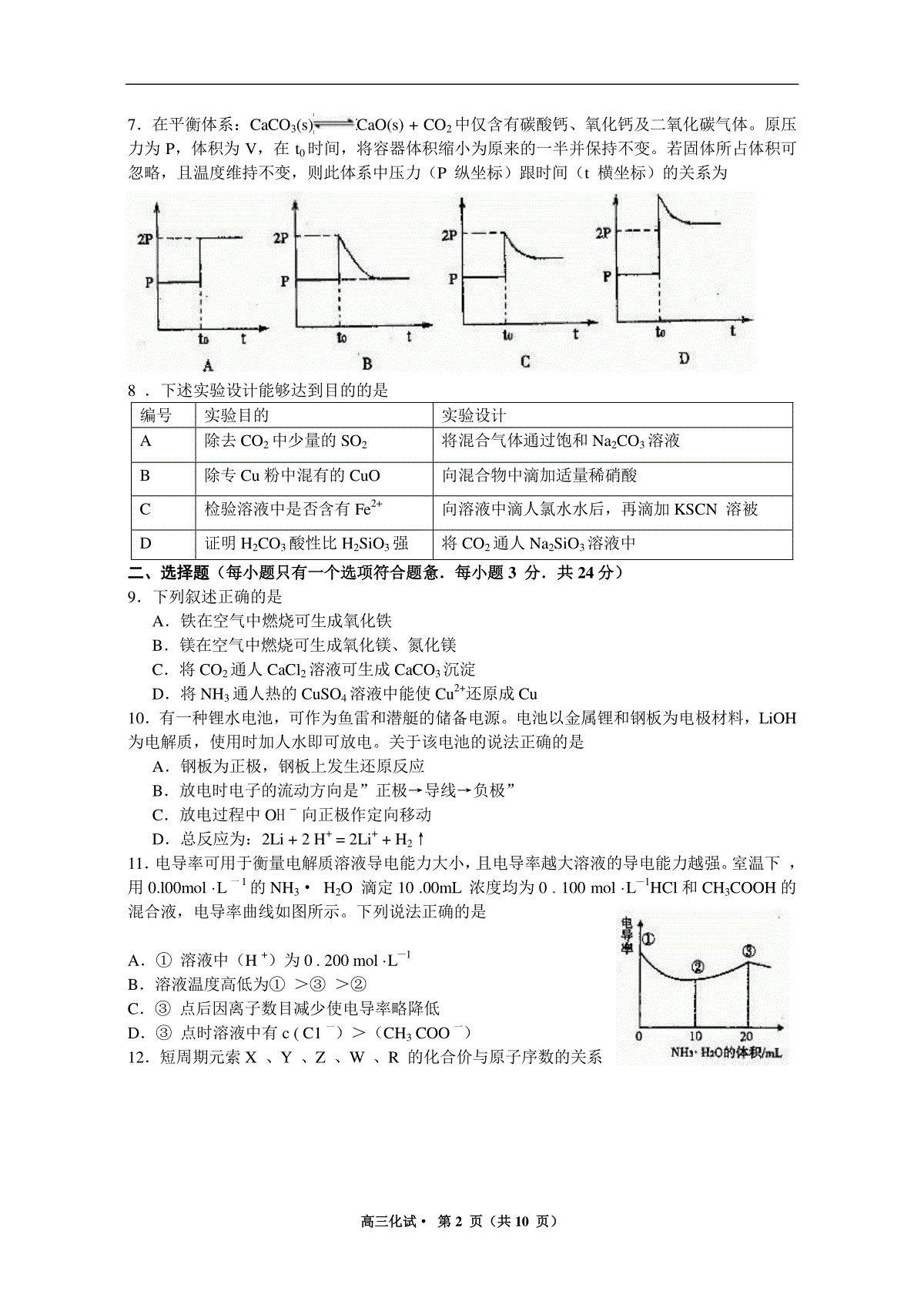
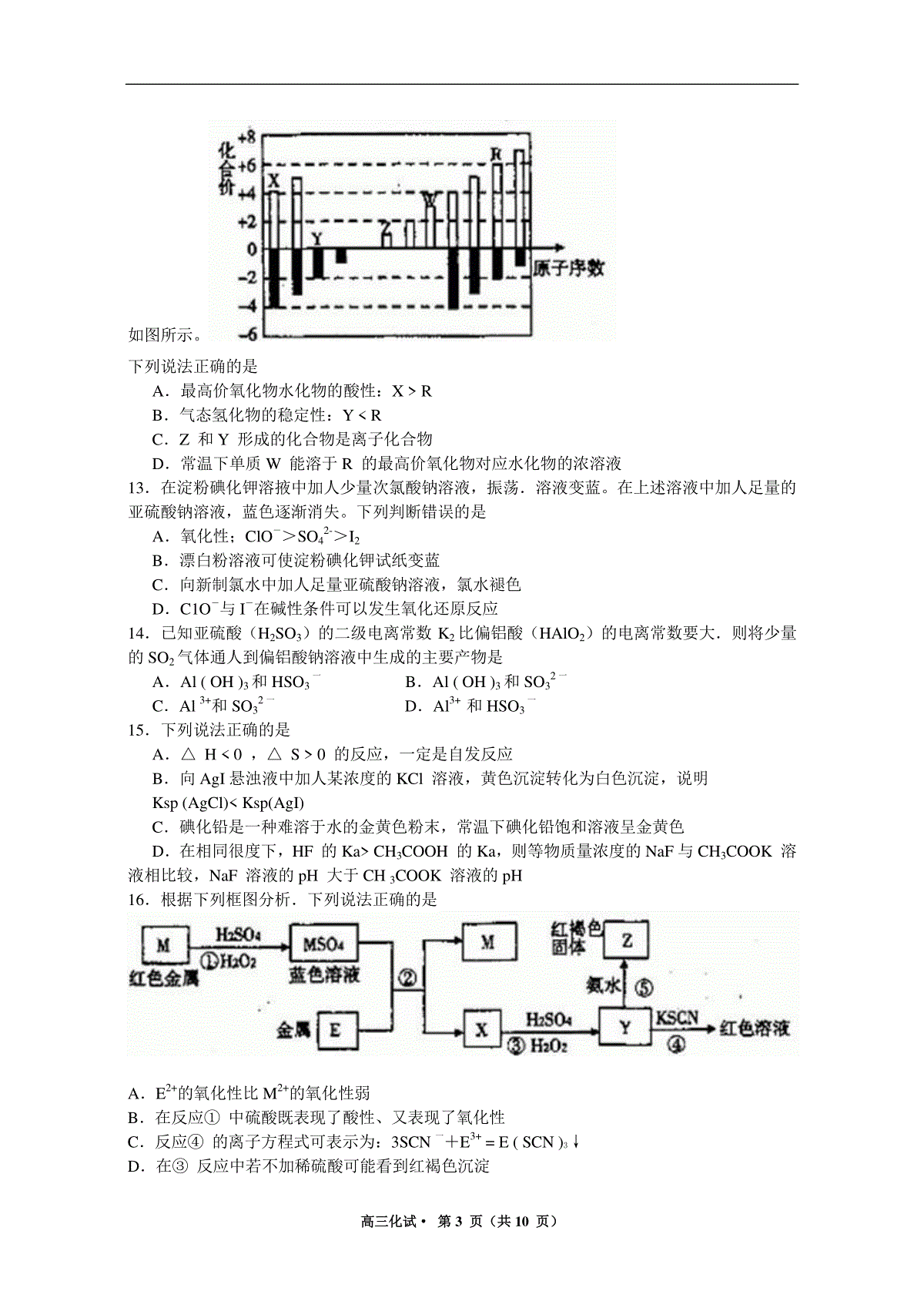
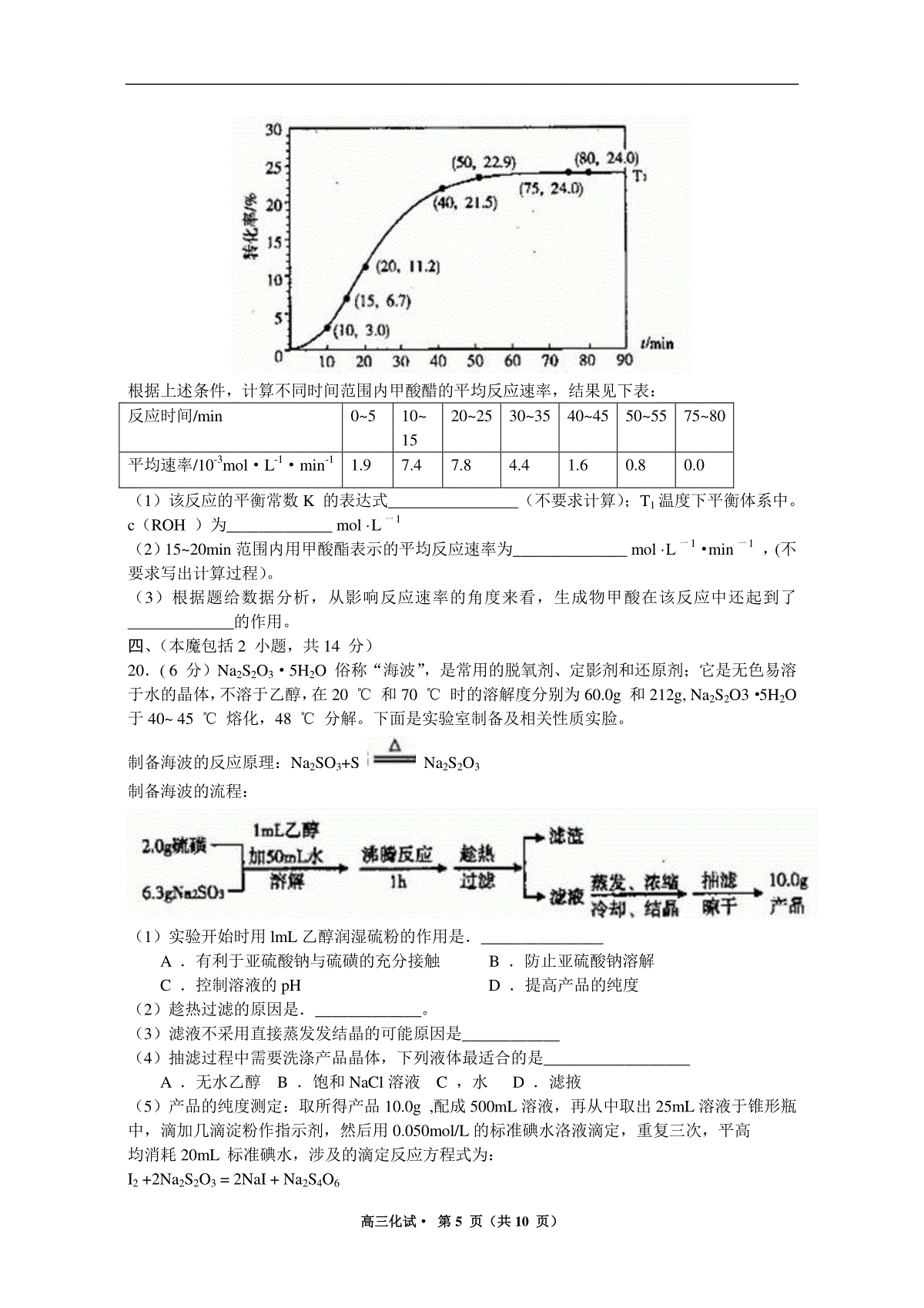
高三化试·第1页(共10页)2013年杭州市第一次高考科目教学质量检测化学试题卷考生须知:1.本卷满分100分,考试时间100分钟。2.答题前,在答题卷密封区内填写学校、班级和姓名。3.所有答案必须写在答题卷上,写在试卷上无效。4.考试结束,只需上交答题卷。相对原子质量:H1C12O16S32Na23Bal37一、选择题(每小题只有一个选项符合题意,每小题2分,共16分)1.下列说法正确的是A.葡萄糖、油脂、蛋白质在一定条件下均可以发生水解反应B.赤铁矿、磁铁矿、黄铁矿、孔雀石都是常见的铁矿石C.石油分馏、煤的气化、海水制食盐、纤维素加工等过程都包含化学变化D.锅炉水垢中含有的CaSO4,可先用Na2CO3溶液处理,后用酸除去2.如图表示汽车尾气净化器处理汽车尾气的过程。有关叙述正确的是A.在上述尾气处理过程中,NOx全部被CO还原B.汽车安装这种净化器后,使用含铅汽油也不会造成铅污染C.铂(Pt)和锗(Rh)都是长周期金属元素,Pt一Rh催化剂可提高尾气平衡转化率D.在上述尾气处理过程中,Rh和CxHy,均是还原剂3.用NA表示阿伏加德罗常数,下列叙述中不正确的是A.3molNO2与量H2O反应,转移电子2molB.1molC5H12分子中含有的共价键数目为17NAC.浓度均为0.lmol/LCH3COONa、CH3COOH混合溶液100mL中所含CH3COO—、CH3COOH的徽粒总数为0.02NAD.标准状况下11.2L的CH4、CD4、CT4的混合气体中含有的质子数为5NA4.已知:乙醇可被强氧化剂氧化为乙酸。BrCH2CH=CHCH2Br可经三步反应制取HOOCCH(Cl)CH2COOH,发生反应的类型依次是A.水解反应、加成反应、氧化反应B.加成反应、水解反应、氧化反应C.水解反应、氧化反应、加成反应D.加成反应、氧化反应、水解反应5.下列实验方案中,合理的是A.可用生石灰除去乙酸中少量水B.用5mL苯与1mL浓溴水反应(Fe粉作催化剂)制溴苯C.向适量浓硝酸、浓硫酸的混合物中逐滴加人苯,在50-60℃的水浴中加热以制取硝基苯D.将2.5g苯酚、2.5mL40%的甲醛溶液混合,沸水浴加热制酚醛树脂6.利用常温下氨与氯气能发生置换反应的性质,氯碱工业生产中用来检查氯气是否泄漏,其模拟装置如图。下列有关说法错误的是A.烧瓶中立即出现白烟B.烧瓶中立即出现红棕色气体C.烧瓶中发生的反应表明常温下氨气有还原性D.烧瓶中还发生了化合反应高三化试·第2页(共10页)7.在平衡体系:CaCO3(s)CaO(s)+CO2中仅含有碳酸钙、氧化钙及二氧化碳气体。原压力为P,体积为V,在t0时间,将容器体积缩小为原来的一半并保持不变。若固体所占体积可忽略,且温度维持不变,则此体系中压力(P纵坐标)跟时间(t横坐标)的关系为8.下述实验设计能够达到目的的是编号实验目的实验设计A除去CO2中少量的SO2将混合气体通过饱和Na2CO3溶液B除专Cu粉中混有的CuO向混合物中滴加适量稀硝酸C检验溶液中是否含有Fe2+向溶液中滴人氯水水后,再滴加KSCN溶被D证明H2CO3酸性比H2SiO3强将CO2通人Na2SiO3溶液中二、选择题(每小题只有一个选项符合题惫.每小题3分.共24分)9.下列叙述正确的是A.铁在空气中燃烧可生成氧化铁B.镁在空气中燃烧可生成氧化镁、氮化镁C.将CO2通人CaCl2溶液可生成CaCO3沉淀D.将NH3通人热的CuSO4溶液中能使Cu2+还原成Cu10.有一种锂水电池,可作为鱼雷和潜艇的储备电源。电池以金属锂和钢板为电极材料,LiOH为电解质,使用时加人水即可放电。关于该电池的说法正确的是A.钢板为正极,钢板上发生还原反应B.放电时电子的流动方向是”正极→导线→负极”C.放电过程中OHˉ向正极作定向移动D.总反应为:2Li+2H+=2Li++H2↑11.电导率可用于衡量电解质溶液导电能力大小,且电导率越大溶液的导电能力越强。室温下,用0.l00mol·L一1的NH3·H2O滴定10.00mL浓度均为0.100mol·L—1HCl和CH3COOH的混合液,电导率曲线如图所示。下列说法正确的是A.①溶液中(H+)为0.200mol·L—1B.溶液温度高低为①>③>②C.③点后因离子数目减少使电导率略降低D.③点时溶液中有c(C1一)>(CH3COO一)12.短周期元索X、Y、Z、W、R的化合价与原子序数的关系高三化试·第3页(共10页)如图所示。下列说法正确的是A.最高价氧化物水化物的酸性:XRB.气态氢化物的稳定性:YRC.Z和Y形成的化合物是离子化合物D.常温下单质W能溶于R的最高价氧化物对应水化物的浓溶液13.在淀粉碘化钾溶掖中加人少量次氯酸钠溶液,振荡.溶液变蓝。在上述溶液中加人足量的亚硫酸钠溶液,蓝色逐渐消失。下列判断错误的是A.氧化性;ClO->SO42->I2B.漂白粉溶液可使淀粉碘化钾试纸变蓝C.向新制氯水中加人足量亚硫酸钠溶液,氯水褪色D.C1O-与I-在碱性条件可以发生氧化还原反应14.已知亚硫酸(H2SO3)的二级电离常数K2比偏铝酸(HAlO2)的电离常数要大.则将少量的SO2气体通人到偏铝酸钠溶液中生成的主要产物是A.Al(OH)3和HSO3一B.Al(OH)3和SO32一C.Al3+和SO32一D.Al3+和HSO3一15.下列说法正确的是A.△H0,△S0的反应,一定是自发反应B.向AgI悬浊液中加人某浓度的KCl溶液,黄色沉淀转化为白色沉淀,说明Ksp(AgCl)Ksp(AgI)C.碘化铅是一种难溶于水的金黄色粉末,常温下碘化铅饱和溶液呈金黄色D.在相同很度下,HF的KaCH3COOH的Ka,则等物质量浓度的NaF与CH3COOK溶液相比较,NaF溶液的pH大于CH3COOK溶液的pH16.根据下列框图分析.下列说法正确的是A.E2+的氧化性比M2+的氧化性弱B.在反应①中硫酸既表现了酸性、又表现了氧化性C.反应④的离子方程式可表示为:3SCN一+E3+=E(SCN)3↓D.在③反应中若不加稀硫酸可能看到红褐色沉淀高三化试·第4页(共10页)三、(本题包括3小题,共20分)17.(6分)下表为元索周期表的一部分,请参照元索①~⑧在表中的位置,回答下列问题;(回答问题时,均需使用元索的真实元索符号,不得使用数字编号)族周期ⅠAⅡAⅢAⅣAⅤAⅥAⅦAⅧ1①2②③④3⑤⑥⑦⑧(1)②、⑤、⑥的旅子半径由大到小的顺序为_______________(2)写出由①、②两元称组成,且①的质量分数最高的分子的电子式______,写出该化合物跟⑧的单质发生置换反应的化学方程式___________________。(3)元索⑥的最高价氧化物可和元素⑤的氢氧化物水溶液发生反应,写出反应的离子方程式_______________________________(4)元素③有多种氧化物,其中甲的相对分子质量最小;元素④有多种单质,其中乙的相对分子质量最小。在一定条件下,将2L甲气体与1.5L乙气体均匀混合,若该混合气体被足量NaOH溶液完全吸收(没有气体残留).所生成的含氧酸盐的化学式是_____________18.(7分)羟胺(NH2OH)可看成是氨分子内的l个氢原子被羟基取代的物质,常用作还原剂,其水溶液显弱碱性。工业上可以用如下流程制取盐酸羟胺(NH2OH·HCl或[NH3OH]+C1—)(1)NH2OH的水溶液呈弱碱性的原理与NH3的水溶液相似,用电离方程式表示NH2OH在水溶液中显碱性的原因_________________。(2)某离子化合物的组成元素与羟胺相同,其水溶液显酸性。用离子方程式表示该离子化合物的水溶液显酸性的原因_____________________________。(3)上述流程①中发生反应的离子方程式为____________________,②中发生反应的离子方程式为__________________,试剂A的化学式为__________________。(4)用盐酸羟胺跟氢氧化钠溶液混合可制取羟胺,写出相关反应的化学方程式_________19.(7分)某种甲酸酯水解反应方程式为:HCOOR(l)+H2O(l)HCOOH(l)+ROH(l)△H0某小组通过实验研究该反应(反应过程中体积变化忽略不计)。反应体系中各组分的起始浓度如下表:组分HCOORH2OHCOOH}ROH物质的量浓度/mol·L一1’1.001.990.010.52甲酸酯转化率在温度T1下随反应时间(t)的变化如下图:.高三化试·第5页(共10页)根据上述条件,计算不同时间范围内甲酸醋的平均反应速率,结果见下表:反应时间/min0~510~1520~2530~3540~4550~5575~80平均速率/10-3mol·L-1·min-11.97.47.84.41.60.80.0(1)该反应的平衡常数K的表达式________________(不要求计算);T1温度下平衡体系中。c(ROH)为_____________mol·L一1(2)15~20min范围内用甲酸酯表示的平均反应速率为______________mol·L一1·min一1,(不要求写出计算过程)。(3)根据题给数据分析,从影响反应速率的角度来看,生成物甲酸在该反应中还起到了_____________的作用。四、(本魔包括2小题,共14分)20.(6分)Na2S2O3·5H2O俗称“海波”,是常用的脱氧剂、定影剂和还原剂;它是无色易溶于水的晶体,不溶于乙醇,在20℃和70℃时的溶解度分别为60.0g和212g,Na2S2O3·5H2O于40~45℃熔化,48℃分解。下面是实验室制备及相关性质实脸。制备海波的反应原理:Na2SO3+SNa2S2O3制备海波的流程:(1)实验开始时用lmL乙醇润湿硫粉的作用是._______________A.有利于亚硫酸钠与硫磺的充分接触B.防止亚硫酸钠溶解C.控制溶液的pHD.提高产品的纯度(2)趁热过滤的原因是._____________。(3)滤液不采用直接蒸发发结晶的可能原因是____________(4)抽滤过程中需要洗涤产品晶体,下列液体最适合的是__________________A.无水乙醇B.饱和NaCl溶液C,水D.滤掖(5)产品的纯度测定:取所得产品10.0g,配成500mL溶液,再从中取出25mL溶液于锥形瓶中,滴加几滴淀粉作指示剂,然后用0.050mol/L的标准碘水洛液滴定,重复三次,平高均消耗20mL标准碘水,涉及的滴定反应方程式为:I2+2Na2S2O3=2NaI+Na2S4O6高三化试·第6页(共10页)产品的中Na2S2O3·5H2O的纯度为______%21.(8分)氯水是实验室常需临时配制的一种试剂.图甲所示的是实验室配制氯水时的一种常用装置,图乙是某化学实脸小组自行设计的一种配制氯水的装置(图中的鼓气球是一种具有气体单向阀的可用于向瓶中鼓人空气的仪器)。图甲(1)氯水需临时配制的原因是:___________________(用化学方程式表示)。(2)图甲所示装置中,烧杯内的液体是__________________。(3)图乙所示装置中,瓶A内的大试管上端管壁钻有一个小孔,瓶A的名称叫_________,该仪器通常用于_____________实验中(填基本实验操作的名称)。(4)用图乙所示装置中配制氯水时,操作步骤如下:①关闭活塞2,打开分液漏斗上口的玻璃塞,再打开活塞1,将少量浓盐酸注人大试管内。②关闭活塞1,盖上分液漏斗上口玻璃塞。浓盐酸和大试管内的高锰酸钾粉末反应产生氯气。③轻轻摇动瓶A,使氯气不断溶入水中。用图乙装置能在较短时间内得到饱和氯水.除了在摇动过程中墩大了气体和水的接触面以外,另一个重要原因是_____________________.分液漏斗中的盐酸应分数次加人试管内.若一次加人太多的盐酸,可能引起的后果是________________________。(5)配制氯水完成后,不必拆卸装置即可从瓶A中取用少量


 三七文档所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。
三七文档所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。
本文标题:2013_年杭州市第一次高考科目教学质量检测化学试卷及答案(答案更正版)
链接地址:https://www.777doc.com/doc-3011383 .html