当前位置:首页 > 商业/管理/HR > 咨询培训 > 实验二____实验基本技能训练_加热操作与试管的使用
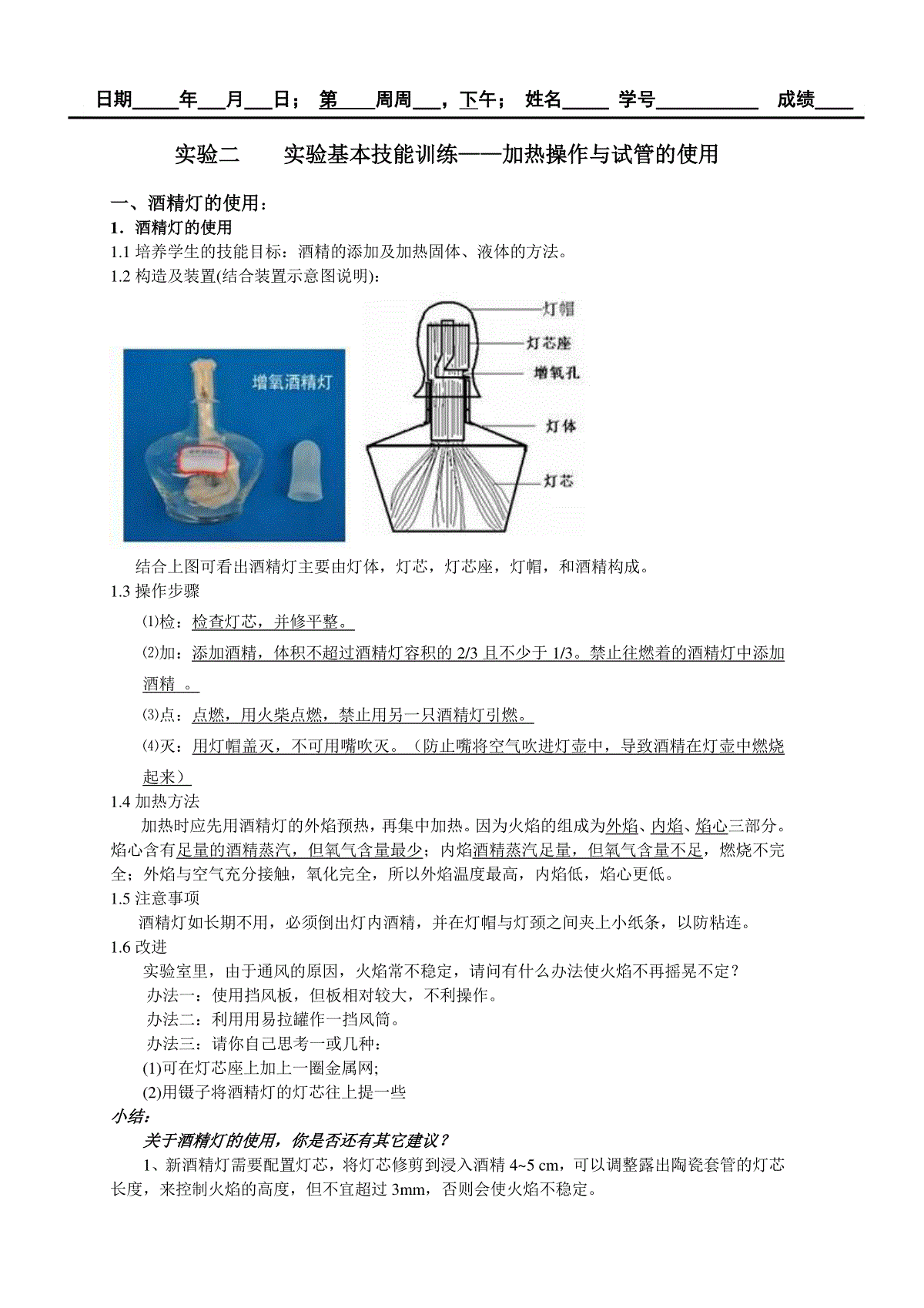
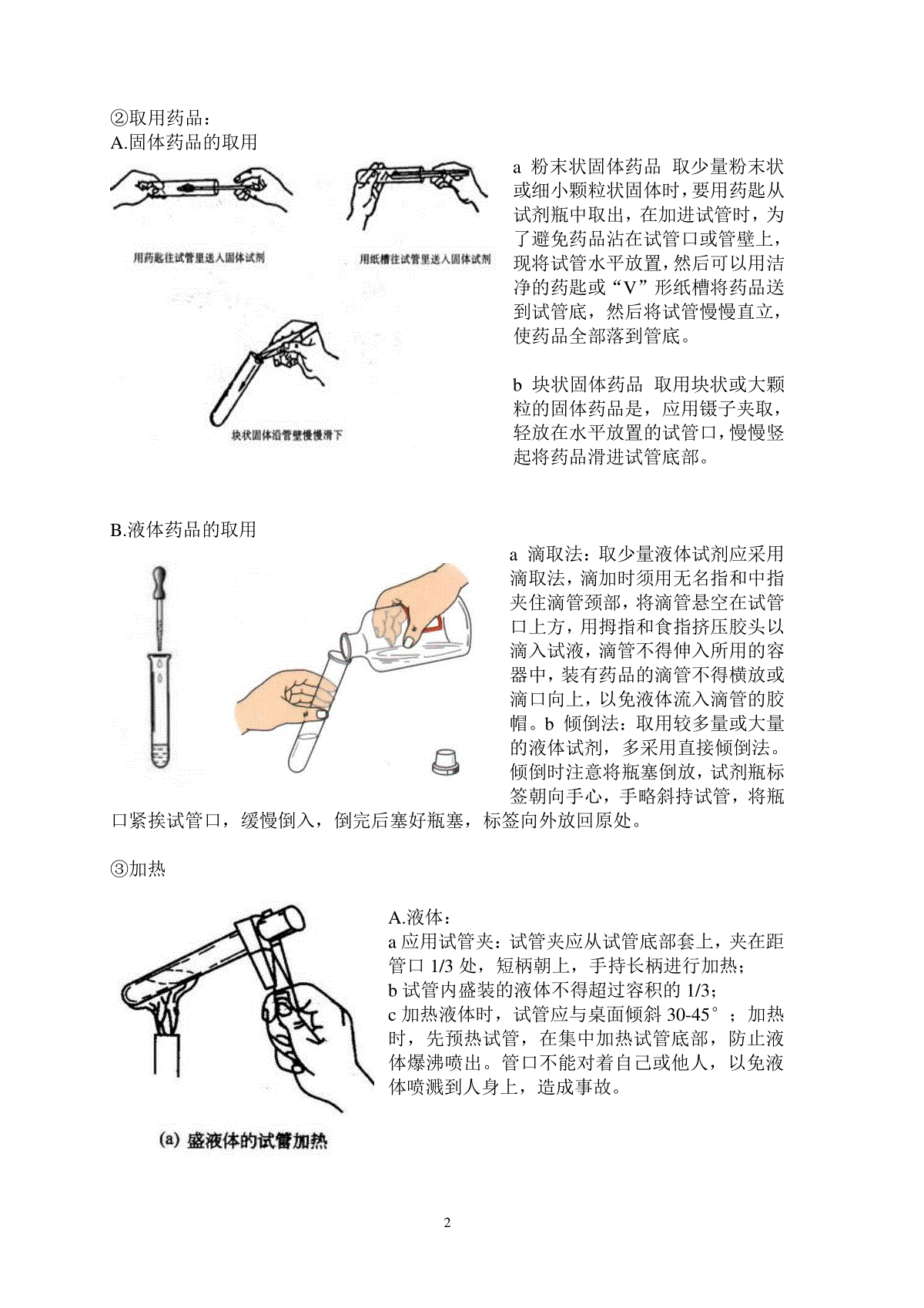
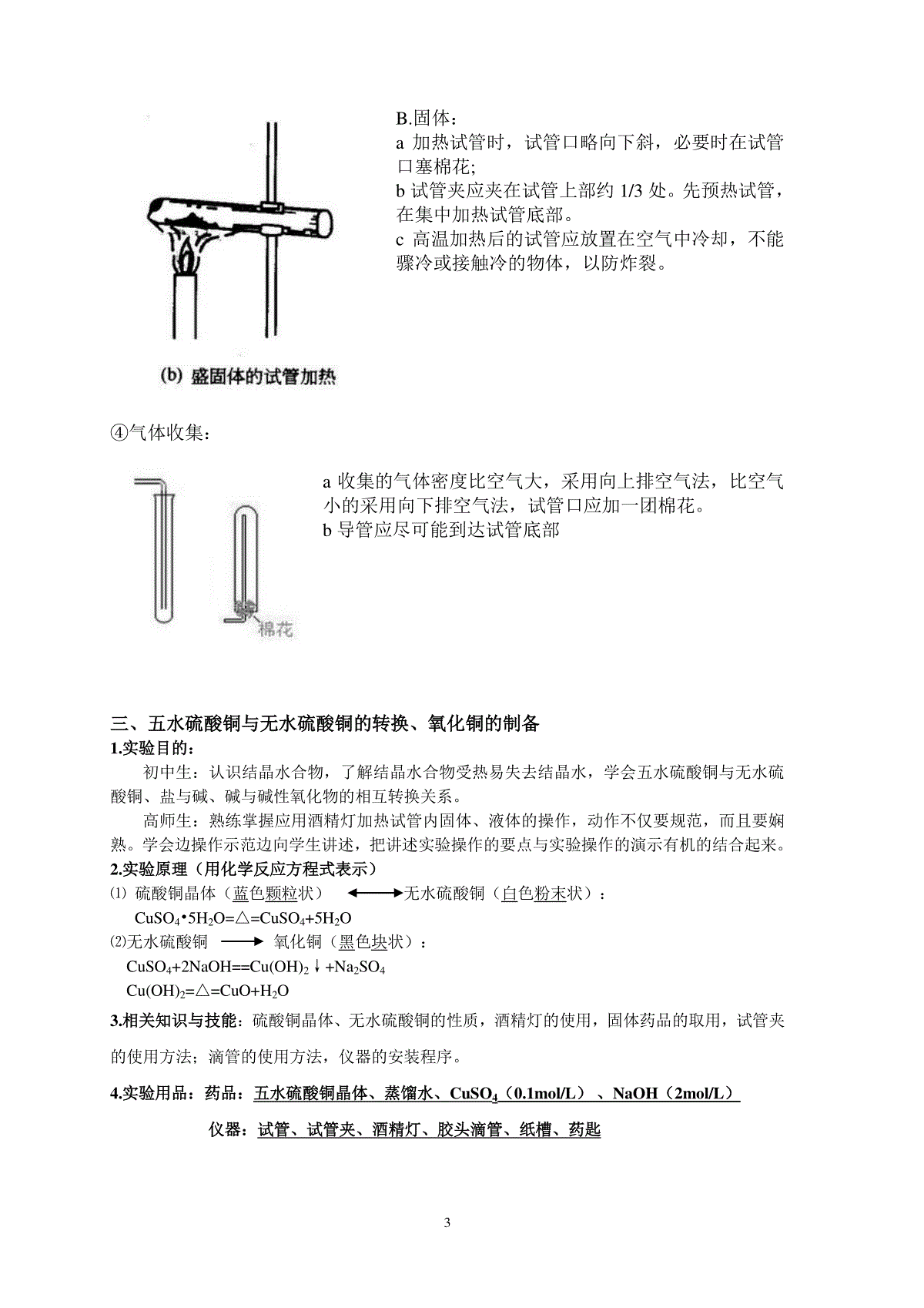
实验二实验基本技能训练——加热操作与试管的使用一、酒精灯的使用:1.酒精灯的使用1.1培养学生的技能目标:酒精的添加及加热固体、液体的方法。1.2构造及装置(结合装置示意图说明):结合上图可看出酒精灯主要由灯体,灯芯,灯芯座,灯帽,和酒精构成。1.3操作步骤⑴检:检查灯芯,并修平整。⑵加:添加酒精,体积不超过酒精灯容积的2/3且不少于1/3。禁止往燃着的酒精灯中添加酒精。⑶点:点燃,用火柴点燃,禁止用另一只酒精灯引燃。⑷灭:用灯帽盖灭,不可用嘴吹灭。(防止嘴将空气吹进灯壶中,导致酒精在灯壶中燃烧起来)1.4加热方法加热时应先用酒精灯的外焰预热,再集中加热。因为火焰的组成为外焰、内焰、焰心三部分。焰心含有足量的酒精蒸汽,但氧气含量最少;内焰酒精蒸汽足量,但氧气含量不足,燃烧不完全;外焰与空气充分接触,氧化完全,所以外焰温度最高,内焰低,焰心更低。1.5注意事项酒精灯如长期不用,必须倒出灯内酒精,并在灯帽与灯颈之间夹上小纸条,以防粘连。1.6改进实验室里,由于通风的原因,火焰常不稳定,请问有什么办法使火焰不再摇晃不定?办法一:使用挡风板,但板相对较大,不利操作。办法二:利用用易拉罐作一挡风筒。办法三:请你自己思考一或几种:(1)可在灯芯座上加上一圈金属网;(2)用镊子将酒精灯的灯芯往上提一些小结:关于酒精灯的使用,你是否还有其它建议?1、新酒精灯需要配置灯芯,将灯芯修剪到浸入酒精4~5cm,可以调整露出陶瓷套管的灯芯长度,来控制火焰的高度,但不宜超过3mm,否则会使火焰不稳定。日期年月日;第周周,下午;姓名学号成绩12、对于旧灯,尤其是长时间没有使用的酒精灯,应该取下灯帽并提起陶瓷套管,用洗耳球或嘴轻轻地向灯壶内吹气,以赶走其中聚集的酒精蒸气,接着再检查灯芯,如果灯芯不整齐或者烧焦的话,应用剪刀修剪整齐。使用前还应该检查灯壶是否有破损。3、酒精灯在使用之前需要检查酒精储量,酒精若少于容积的1/2,就应该添加酒精,但酒精不能超过容积的2/3。添加酒精应将陶瓷套管取出,用漏斗或者玻璃棒引流添加,以免漏撒,而点燃的酒精灯应先熄灭再添加,否则容易引起火灾。添加酒精后还应该擦拭桌面,保持干净干燥,以免点火时发生危险。4、点燃酒精灯前要调整灯芯,使得灯芯浸满酒精,否则容易将灯芯烧焦。点燃酒精灯必须使用火柴,不能用已经点燃的酒精灯来引燃另一个酒精灯,否则容易使酒精撒漏引起火灾。5、使用中的酒精灯,应放置在适当的高度,使用木块垫高,不能使用书本。挡风可以使用专用挡板,也不能使用书本。使用中不可以倾斜拿取和放置,以免酒精撒出,谨防碰倒酒精灯。6、如果需要稳定火焰以及提高火焰温度,可以在火焰周围增加一个金属网罩。使用酒精灯应该遵守实验室规则。7、若酒精灯不慎翻倒,造成小面积着火,可以使用湿抹布盖灭。火熄灭后,不可立即移开抹布,否则可能引起复燃。如果大面积着火,甚至发生火灾,应使用灭火器灭火,并且报告消防部门。灭火后还应该打开门窗通风,使酒精蒸气排散。如果发生烧伤,应该按烧伤处理方法及时处理。8、不用的酒精灯必须罩上灯帽,以免酒精挥发,因为酒精灯中酒精含水,所以挥发后有水在灯芯上,致使酒精灯无法点燃;长时间不用的酒精灯应将酒精倒出,将灯壶放好。9、盖灭酒精灯时,需先盖一次,稍后拔出灯帽再盖一次。因为盖灭火焰时,灯盖里的氧气会消耗,使灯帽里的压强小于外界的压强,所以稍后拔出灯帽再盖一次,既可以确保火焰熄灭,又可以避免灯帽及灯帽内气体热胀冷缩而难以拔出灯帽。二、试管的使用1.实验目的:熟悉试管的用途;熟练掌握试管操作2.思考与练习:⑴试管的用途:盛放与加热固体、液体;收集气体;用作少量物质的反应容器。⑵试管操作训练:(结合图形写出注意事项)试管的持拿(手持、试管夹);取用固体、液体的操作;固体、液体的加热;气体的收集;试管的持拿:①试管的持拿:试管夹:从试管底部套入,夹在剧试管口1/3处。手握于试管上半部2②取用药品:A.固体药品的取用a粉末状固体药品取少量粉末状或细小颗粒状固体时,要用药匙从试剂瓶中取出,在加进试管时,为了避免药品沾在试管口或管壁上,现将试管水平放置,然后可以用洁净的药匙或“V”形纸槽将药品送到试管底,然后将试管慢慢直立,使药品全部落到管底。b块状固体药品取用块状或大颗粒的固体药品是,应用镊子夹取,轻放在水平放置的试管口,慢慢竖起将药品滑进试管底部。B.液体药品的取用a滴取法:取少量液体试剂应采用滴取法,滴加时须用无名指和中指夹住滴管颈部,将滴管悬空在试管口上方,用拇指和食指挤压胶头以滴入试液,滴管不得伸入所用的容器中,装有药品的滴管不得横放或滴口向上,以免液体流入滴管的胶帽。b倾倒法:取用较多量或大量的液体试剂,多采用直接倾倒法。倾倒时注意将瓶塞倒放,试剂瓶标签朝向手心,手略斜持试管,将瓶口紧挨试管口,缓慢倒入,倒完后塞好瓶塞,标签向外放回原处。③加热A.液体:a应用试管夹:试管夹应从试管底部套上,夹在距管口1/3处,短柄朝上,手持长柄进行加热;b试管内盛装的液体不得超过容积的1/3;c加热液体时,试管应与桌面倾斜30-45°;加热时,先预热试管,在集中加热试管底部,防止液体爆沸喷出。管口不能对着自己或他人,以免液体喷溅到人身上,造成事故。3B.固体:a加热试管时,试管口略向下斜,必要时在试管口塞棉花;b试管夹应夹在试管上部约1/3处。先预热试管,在集中加热试管底部。c高温加热后的试管应放置在空气中冷却,不能骤冷或接触冷的物体,以防炸裂。④气体收集:a收集的气体密度比空气大,采用向上排空气法,比空气小的采用向下排空气法,试管口应加一团棉花。b导管应尽可能到达试管底部三、五水硫酸铜与无水硫酸铜的转换、氧化铜的制备1.实验目的:初中生:认识结晶水合物,了解结晶水合物受热易失去结晶水,学会五水硫酸铜与无水硫酸铜、盐与碱、碱与碱性氧化物的相互转换关系。高师生:熟练掌握应用酒精灯加热试管内固体、液体的操作,动作不仅要规范,而且要娴熟。学会边操作示范边向学生讲述,把讲述实验操作的要点与实验操作的演示有机的结合起来。2.实验原理(用化学反应方程式表示)⑴硫酸铜晶体(蓝色颗粒状)无水硫酸铜(白色粉末状):CuSO4•5H2O=△=CuSO4+5H2O⑵无水硫酸铜氧化铜(黑色块状):CuSO4+2NaOH==Cu(OH)2↓+Na2SO4Cu(OH)2=△=CuO+H2O3.相关知识与技能:硫酸铜晶体、无水硫酸铜的性质,酒精灯的使用,固体药品的取用,试管夹的使用方法;滴管的使用方法,仪器的安装程序。4.实验用品:药品:五水硫酸铜晶体、蒸馏水、CuSO4(0.1mol/L)、NaOH(2mol/L)仪器:试管、试管夹、酒精灯、胶头滴管、纸槽、药匙45.实验操作步骤5.1向试管中加入适量的五水硫酸铜:加入药品时应用纸槽送到试管底部,并轻轻振平药品。5.2加热:先预热试管,再集中加热试管底部,注意试管口应略向下倾斜,请问:试管应如何倾斜,其原因试管应该向下倾斜,防止在试管中冷凝的水蒸气回流到试管底部使试管炸裂。观察现象:蓝色颗粒状固体逐渐变成白色粉末状,壁管有大量水珠,管口有少量白雾生成。5.3取下试管,冷却后加入几滴水,观察现象:白色粉末变为蓝色,并且试管底部温度升高,继续加水,粉末部分溶解,溶液呈蓝色。5.4继续往此试管加入氢氧化钠溶液,观察现象:生成了蓝色絮状沉淀。5.5加热此试管,又有何现象:蓝色沉淀转变为黑褐色固体,溶液沸腾,同时有黑色固体粘在管壁。56.实验注意事项:6.1试管安装时,试管口应略向下倾斜。6.2加热要缓慢,均匀,温度不能过高,硫酸铜变白后即停止加热。因为:空气中有水蒸气,与硫酸铜发生反应生成氧化铜,反应方程式:CuSO4+H2O≜CuO+H2SO4。6.3如果五水硫酸铜晶体在试管底部铺得较长,则应如何加热?平稳移动试管,从试管底部逐渐向试管口加热。四、硝酸钾与碳的反应先查阅硝酸钾的熔点(334℃);画出实验装置图,并描述实验步骤和实验现象。实验步骤实验现象1、取一支大试管垂直固定在铁架台上,加入一药匙的硝酸钾和一颗黄豆大小的木炭块,加热,观察现象。白色固体(硝酸钾)逐渐熔化为无色液体。继续加热有气泡产生,待硝酸钾全部熔化后,木炭忽然在试管中上下跳动,一会后发出明亮火光,并有大量白烟。移去酒精灯后溶液从最初的无色变成了浅绿色,静置冷却后有白色固体析出。实验分析:硝酸钾受热先熔化后分解为亚硝酸钾和氧气,加入木炭后木炭受热与氧气发生反应,生成的二氧化碳将木炭推上去,后木炭又应重力作用落下,形成跳动。反应方程式:2KNO3====2KNO2+O2↑C+O2====CO△点燃6实验装置图:五、硫酸铜与氢氧化钠的反应探究将不同量的硫酸铜加入到不同量的氢氧化钠溶液中,使硫酸铜与氢氧化钠按照不同的比例反应。编号A(0.1mol/LCuSO4)B(2mol/LNaOH)n(A):n(B)140滴2滴1:1220滴2滴1:2320滴4滴1:442滴20滴1:20实验现象:7编号1:产生浅蓝绿色絮状沉淀,加热后静置,溶液分层,上层为澄清液体,下层为浅蓝绿色絮状沉淀。编号2:产生浅蓝色絮状沉淀,加热后沉淀变成棕褐色,试管壁上有少量棕褐色沉淀。编号3:产生绛蓝色絮状沉淀,加热后沉淀变成棕褐色,试管壁上有大量黑褐色沉淀。编号4:加入NaOH溶液后,变为浅蓝紫色澄清溶液,加热后,无明显现象。实验分析:根据相关文献可知,氢氧化钠与硫酸铜反应有一下几种可能产物:名称性质CuSO4•Cu(OH)2浅蓝色絮状沉淀,CuSO4•Cu(OH)2稳定,受热不易分解,加热后现象不变(CuSO4过量)Cu2(OH)2SO4绿色单斜晶体,在水中溶解度极小,加热至600℃会生成氧化铜二氧化硫和水Cu(OH)2蓝色絮状沉淀,常温下不溶于水,Cu(OH)2不稳定,受热分解为氧化铜和水Na2[Cu(OH)4]绛蓝色溶液(NaOH过量)实验结论:(1)结合实验现象和上述资料可得:硫酸铜与氢氧化钠的反应得到的产物的主要成分是如下:编号1:CuSO4•Cu(OH)2编号2:Cu2(OH)2SO4编号3:Cu(OH)2编号4:Na2[Cu(OH)4](2)影响硫酸铜与氢氧化钠溶液反应生成不同产物的因素主要有硫酸铜与氢氧化钠溶液浓度和用量。六、实验反思本周一共进行了三个实验,并且讲解了酒精灯和试管的用法,也在实验中很好的进行了实8践。这三个实验看似简单,却是中学化学中最常用的基本操作。以下是我对实验的反思。(一)基础操作通过课前的预习和其他同学的演示操作及讲解,我们巩固了酒精灯和试管操作的注意事项,同时通过自己的实践操作,将所学落实实践,去进行实验,在实践中认识自己的不足。手抖还是一个比较大的问题。(二)五水硫酸铜与无水硫酸铜的转换、氧化铜的制备1.加热后有少量冷凝水在试管口,试管不可立刻竖直,应待试管冷却,防止冷凝水倒流试管炸裂。2.制备氧化铜时,要注意硫酸铜与氢氧化钠的配比,当氢氧化钠不足或过量时,产物的主要成分为CuSO4•Cu(OH)2或Na2[Cu(OH)4],会导致加热时不产生黑色沉淀,或者沉淀不明显,导致制备氧化铜失败。(三)硝酸钾与碳的反应注意木炭的大小,不能太大,反正反应过于剧烈(四)硫酸铜与氢氧化钠的反应探究给我的感觉是:很多化学反应中,不是给定了反应物就能得到唯一的产物,在不同的条件下会得到不同的产物,因此要对其进行探究,也要注意以后在做这个实验要注意好硫酸铜与氢氧化钠的浓度和配比。


 三七文档所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。
三七文档所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。
本文标题:实验二____实验基本技能训练_加热操作与试管的使用
链接地址:https://www.777doc.com/doc-3221658 .html