当前位置:首页 > 商业/管理/HR > 招聘面试 > 全国高中化学竞赛试题集萃(三)
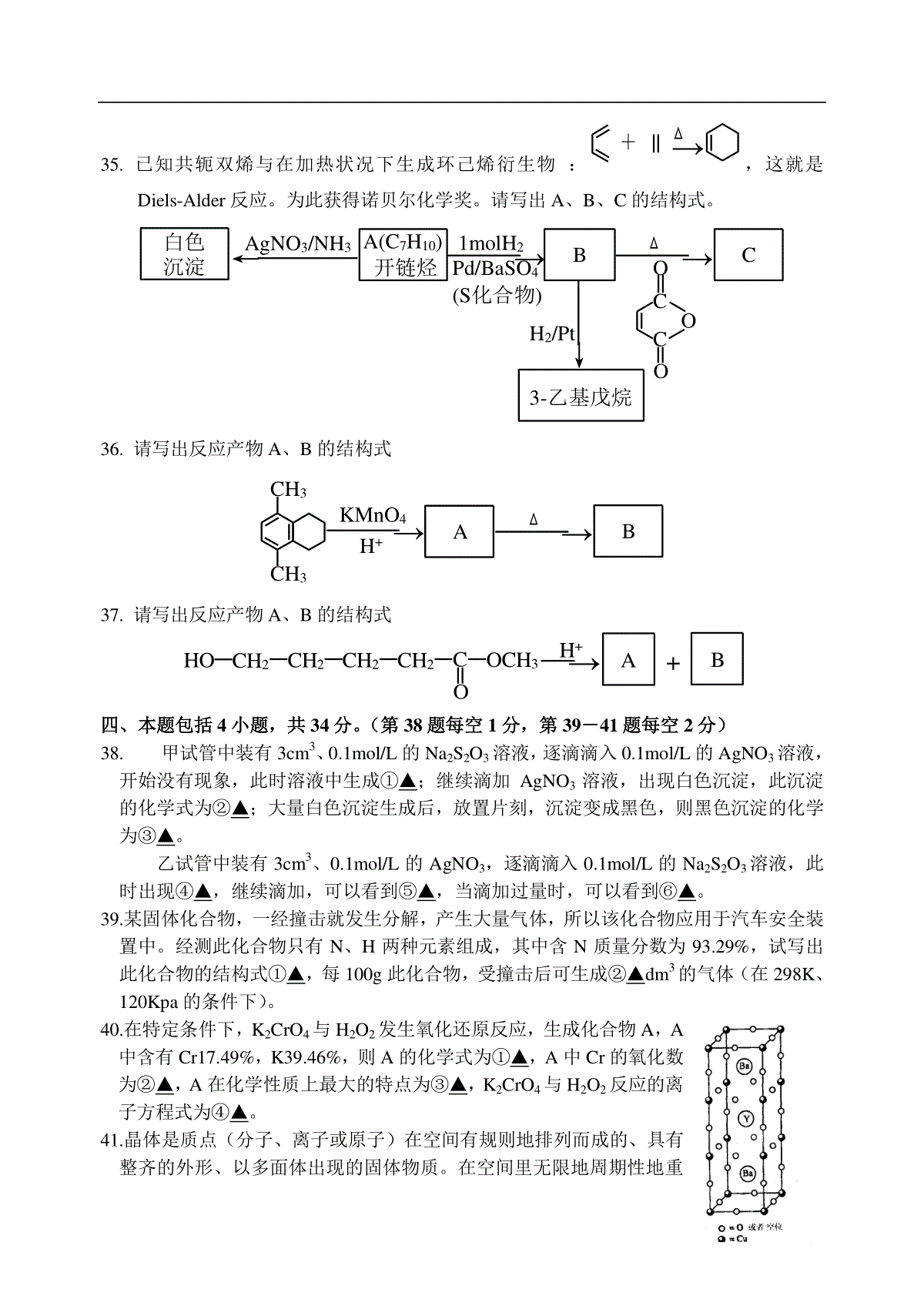
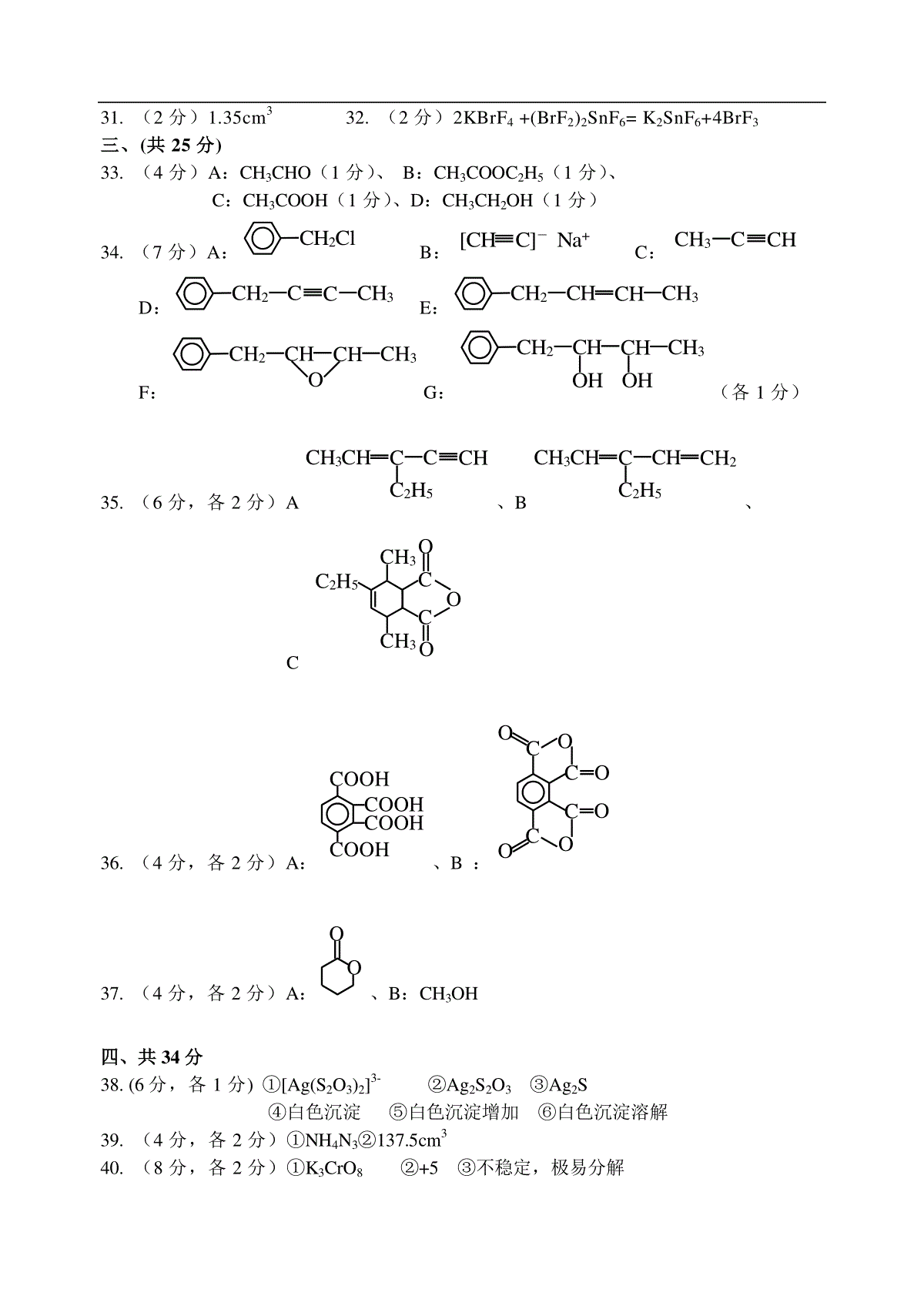
全国高中化学竞赛试题集萃(三)二、本题包括7小题,共24分。(第26-28题每空1分,第29-32题每空题2分)26.填写合适的物质:⑴在Mg(HCO3)2溶液中加入过量澄清石灰水,最终生成的沉淀是▲。⑵在含有浓度大致相当的Cl-、Br-、I-、S2-等离子的混合液中逐滴滴加AgNO3溶液,最先产生的沉淀是▲。⑶用Pt电极电解Cu(NO3)2和NaCl的混合液,在阳极上首先放出①▲;在阴极上首先析出的物质是②▲。27.纯液态IF5的导电性比预估的要强的多。试指出在该体系中存在的物种为①▲、▲、▲;所对应的几何构型为②▲、▲、▲。28.我国研制的一种闪灼材料BGO,它是Bi、Ge、O三种元素组成的化合物。若以氧化物形式写其化学式,发现Bi和Ge氧化物中含氧的总量相等。由于Bi的金属性比Ge的金属性①▲(填强、弱或相近),所以可书写其盐的化学式为②▲。29.氨与氧化铜反应制备氮气,氮气与镁在高温下反应可制得氮化镁。请在⑴、⑵、⑶中填写合适的物质和反应条件,完成从实验室制氨气开始到最终制氮化镁的实验方案示意图(实验前系统内的空气已排除;图中箭头表示气体流向。)⑴→⑵→⑶→镁粉(高温)→以下从略30.CS2是一种恶臭的液体,可用硫酸酸化的高锰酸钾溶液来处理它,生成溶液并析出固体和放出气体。此反应的化学方程式为▲。31.7.68gCu与一定量浓硝酸反应,当铜消耗完时,收集的气体为4.48cm3。若把装有这些气体的集气瓶倒立在盛水的水槽中,需通入▲cm3氧气才能使集气瓶充满溶液。(气体体积以标准状况计)32.试用反应方程式表示在液态BrF3中用KBrF4滴定SnBr2F10会出现电导最低。▲三、本题包括5小题,共25分。(第34、34每空1分,第35-37题每空2分)33.有A、B两种烃的含氧衍生物,它们具有相同的组成,A的相对分子质量是44,B的相对分子质量为88。A能发生银镜反应,而B不能。A经银镜反应后生成C,B可在酸或碱催化下与水反应生成C和D。D在Ag催化作用下可被空气氧化为A。C的钠盐(无水)与碱石灰混合后加热,可得一个相对分子质量为16的气态烷烃。请写出A、B、C、D的结构式。34.请写出A-G的结构式CHCHNaNH2BCH3I→→CNaNH2→→DH2/Pd(BaSO4)(含硫化合物)→E过氧乙酸FH3O+GA→1molCl2hγCH335.已知共轭双烯与在加热状况下生成环己烯衍生物:→+△,这就是Diels-Alder反应。为此获得诺贝尔化学奖。请写出A、B、C的结构式。白色沉淀AgNO3/NH3A(C7H10)开链烃→1molH2Pd/BaSO4(S化合物)BC△OCCOO→3-乙基戊烷H2/Pt36.请写出反应产物A、B的结构式CH3CH3→KMnO4H+AB△→37.请写出反应产物A、B的结构式→H+AB+HOCH2OCH3COCH2CH2CH2四、本题包括4小题,共34分。(第38题每空1分,第39-41题每空2分)38.甲试管中装有3cm3、0.1mol/L的Na2S2O3溶液,逐滴滴入0.1mol/L的AgNO3溶液,开始没有现象,此时溶液中生成①▲;继续滴加AgNO3溶液,出现白色沉淀,此沉淀的化学式为②▲;大量白色沉淀生成后,放置片刻,沉淀变成黑色,则黑色沉淀的化学为③▲。乙试管中装有3cm3、0.1mol/L的AgNO3,逐滴滴入0.1mol/L的Na2S2O3溶液,此时出现④▲,继续滴加,可以看到⑤▲,当滴加过量时,可以看到⑥▲。39.某固体化合物,一经撞击就发生分解,产生大量气体,所以该化合物应用于汽车安全装置中。经测此化合物只有N、H两种元素组成,其中含N质量分数为93.29%,试写出此化合物的结构式①▲,每100g此化合物,受撞击后可生成②▲dm3的气体(在298K、120Kpa的条件下)。40.在特定条件下,K2CrO4与H2O2发生氧化还原反应,生成化合物A,A中含有Cr17.49%,K39.46%,则A的化学式为①▲,A中Cr的氧化数为②▲,A在化学性质上最大的特点为③▲,K2CrO4与H2O2反应的离子方程式为④▲。41.晶体是质点(分子、离子或原子)在空间有规则地排列而成的、具有整齐的外形、以多面体出现的固体物质。在空间里无限地周期性地重复能成为晶体具有代表性的最小单位,称为单元晶胞(平行六面体)。晶胞顶点质点对其晶胞的贡献为1/8,棱上质点为1/4,面上质点为1/2。⑴1987年科学家发现了高温超导体钇钡铜氧材料,其晶胞如右图所示。若该晶胞中不存在氧空位,则该材料的理想化学式为①▲,Cu的实际氧化数为②▲。⑵事实上该材料中存在着氧空位,实际测量该材料的密度ρ=6.377g·cm-3,列式①▲推算出该材料的化学式②▲(已知晶胞参数为a=0.3823nm,b=0.3885nm,c=1.168nm),在该材料中Cu的氧化数为③▲;该晶胞中氧空位的分数为④▲。⑶有的材料中氧空位分数会增加,这是因为①▲;有材料中氧空位分数会减少,这是因为②▲。五、本题包括3小题,共17分。(第42题4分,第43题5分,第44题8分)42.已知固体A是带有2个结晶水的晶体。称取154gA配成1dm3溶液,其浓度恰好是1.00mol/L。经电导证实此溶液含有1mol/LNa+和1mol/L的一价负离子。A的制备反应之一是在NaOH溶液中加入等摩尔的甲醛和Na2S2O4反应,产物为A和Na2SO3。A具有漂白性,经测定A中含有一个亚磺酸基、一个OH基。则A的结构式为①▲。制备A的化学反应方程式为②▲。43.现用如下方法测定钢铁中硫的含量:先准备一只吸收瓶,瓶中盛有50.0cm30.40%的酸性淀粉溶液(内含0.0075gKI),再往其中滴入1滴标准碘酸钾溶液,注意此时溶液的颜色。把试样放在O2中充分燃烧,生成的气体通入上述吸收瓶,同时用装有标准碘酸钾溶液的滴定管不断进行滴定,以溶液恢复到起始时的颜色为终点。标准碘酸钾溶液的配制方法如下:称取0.3560g基准碘酸钾溶于适量水中,移到1dm3容量瓶中,加入1.0cm310%KOH溶液,稀释到刻度,摇匀。移取100.0cm3此液至另一只1dm3容量瓶中,加入1.000gKI,溶解后,加水稀释到刻度,摇匀,以此液为滴定液。⑴计算碘酸钾标准溶液(滴定液)的物质的量浓度。⑵为什么淀粉溶液要配成酸性溶液?而碘酸钾标准溶液却配成碱性溶液?⑶若钢样为0.5000g,消耗碘酸钾标准溶液的体积为10.00cm3,计算钢样中硫的质量分数?(必须写出滴定反应方程式)44.α-AgI是一种固体导体,导电率很高。为了研究α-AgI究竟是Ag+离子导电还是I-离子导电,请设计一个简便的电化学实验。写出实验结果并对结果进行说明。参考答案二、(共24分)26.(4分)⑴Mg(OH)2、CaCO3(1分,全对给分)⑵Ag2S(1分)⑶①Cl2(1分);②Cu(1分)。27.(6分)①IF5、IF4+、IF6-;(3分)②三角双锥、歪四面体、畸变八面体(3分)28.(2分)①强(1分)②Bi2(GeO4)3(1分)29.(6分)⑴NH4Cl固体、Ca(OH)2固体、加热(各1分)⑵CuO粉末、加热(各1分)⑶浓硫酸(1分)30.(2分)5CS2+4KMnO4+6H2SO4=10S↓+5CO2↑+4MnSO4+2K2SO4+6H2O31.(2分)1.35cm332.(2分)2KBrF4+(BrF2)2SnF6=K2SnF6+4BrF3三、(共25分)33.(4分)A:CH3CHO(1分)、B:CH3COOC2H5(1分)、C:CH3COOH(1分)、D:CH3CH2OH(1分)34.(7分)A:CH2ClB:[CHC]-Na+C:CH3CCHD:CH2CCCH3E:CH2CHCHCH3F:CH2CHCHCH3OG:CH2CHCHCH3OHOH(各1分)35.(6分,各2分)ACH3CHCCCHC2H5、BCH3CHCCHCH2C2H5、COCCOOCH3CH3C2H536.(4分,各2分)A:COOHCOOHCOOHCOOH、B:OCCCCOOOOO37.(4分,各2分)A:OO、B:CH3OH四、共34分38.(6分,各1分)①[Ag(S2O3)2]3-②Ag2S2O3③Ag2S④白色沉淀⑤白色沉淀增加⑥白色沉淀溶解39.(4分,各2分)①NH4N3②137.5cm340.(8分,各2分)①K3CrO8②+5③不稳定,极易分解④2CrO42-+9H2O2+2OH-=2CrO83-+O2↑+10H2O41.(16分)⑴①Ba2YCu3O9(2分)②+3,+4(各1分)⑵①ρ2MBa+MY+3MCu+xMON0×a×b×c×10-21(g·cm-3)(2分)(用数字表示正确的,同样给分)②Ba2YCu3O7(2分)③+2,+3(各1分)④2/9(22.22%)(2分)⑶①根据电荷守恒原理,当+2氧化态Cu含量增大时,氧空位分数会增加。(2分)②当+3氧化态Cu含量增大时,氧空位分数会减少。(2分)五、共17分42.(4分)①HOCHHSOONa+(2分)②Na2S2O4+HClO+NaOH=HOCH2SO2Na+Na2SO3(2分)43.(5分)⑴CKIO30.3560214.0×101.664mol·L-1(1分)⑵由于标准溶液中含KIO3和KI,在碱性介质中不会发生生成I2的反应,所以需要碱性。(1分)当标准溶液滴入吸收液时,介质由碱性变成酸性,则发生如下反应:IO3-+5I-+6H+=3I2+3H2O(1分)I2+SO2+2H2O=2I-+SO42-+4H+(1分)∴吸收液必须酸性。⑶S%10.00×1.664×10-4×32.07×31000×0.5000×100%0.0320%(1分)44.(8分)(4分)阳极:Ag–e→Ag+阴极:Ag++e→Ag若Ag+导电,正极Ag不断减薄,负极Ag不断增加,α-AgI本身无变化。(2分)若I-导电,I-与Ag+形成AgI,将比较集中于靠近正极附近,使α-AgI晶体密度不均匀。(2分)



 三七文档所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。
三七文档所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。
本文标题:全国高中化学竞赛试题集萃(三)
链接地址:https://www.777doc.com/doc-7565901 .html