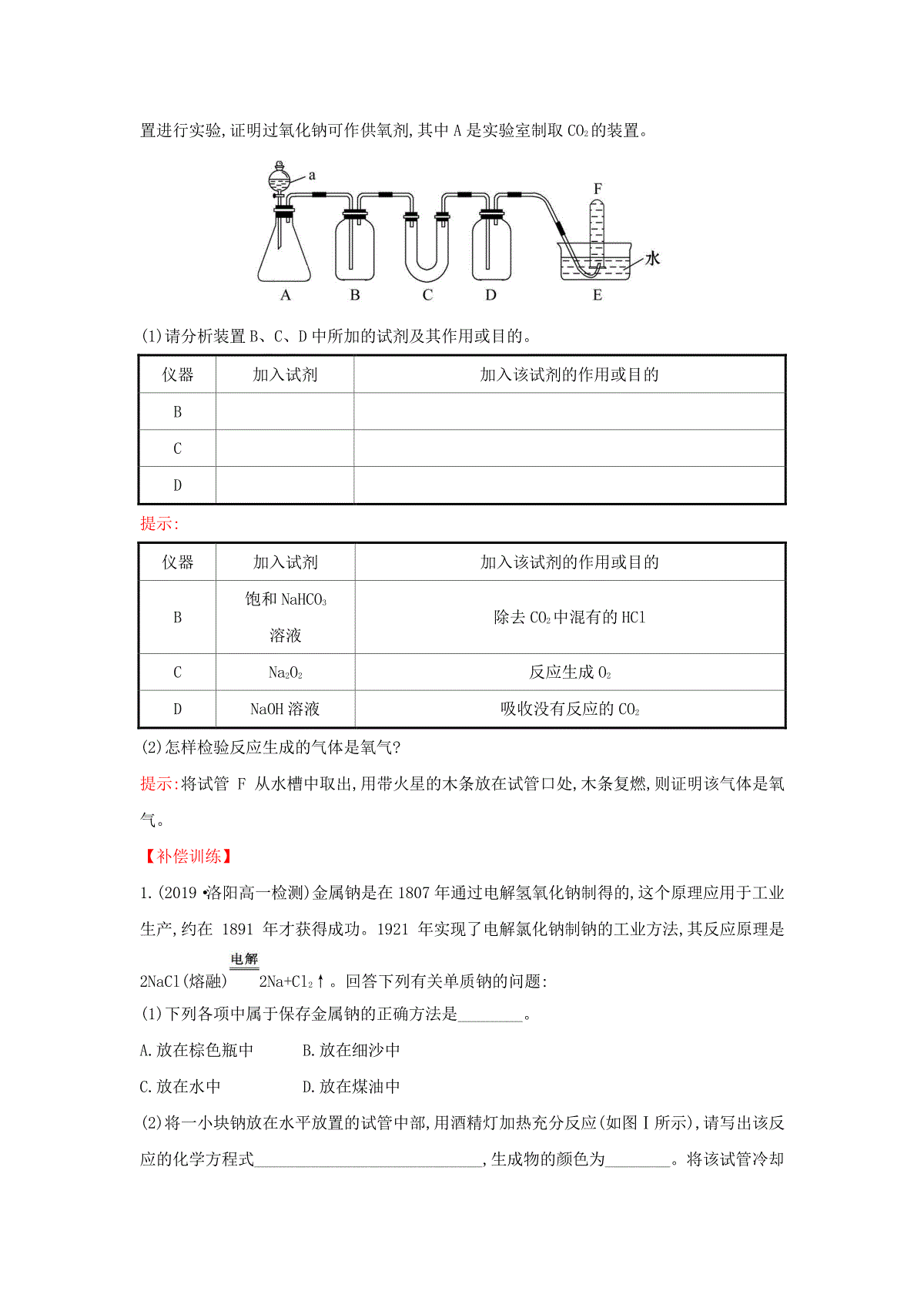
研究物质性质的基本方法(30分钟50分)一、选择题(本题包括5小题,每小题4分,共20分)1.(2019·长沙高一检测)查阅资料发现,金属钠不仅能够跟氧气和水反应,还能跟多种其他物质发生反应,其中包括与酒精在常温下反应,要研究金属钠跟酒精的反应以及它与金属钠跟水反应的异同点,下列研究方法中用不着的是()A.实验法B.观察法C.分类法D.比较法【解析】选C。本题中需要做实验比较两个反应的异同点,所以需要用到实验法和比较法,另外还要观察相关的实验现象,所以还需要用到观察法。【补偿训练】以下是某探究活动中,使用了多种研究物质性质的方法,其中没有涉及的是()课题金属钠与氧气反应的实验实验目的(1)探究金属钠与氧气的反应(2)认识条件控制在实验研究中的意义仪器与试剂金属钠、酒精灯、石棉网、铁架台、铁圈等实验步骤(1)将切好的金属钠放置在空气中,使其与氧气反应(2)将金属钠放在石棉网上加热,使其与氧气反应实验记录A.实验法B.观察法C.分类法D.比较法【解析】选C。在本次探究活动中,为了研究钠的性质,分别做了钠在空气中自然放置、在空气中加热两个对比实验,通过感官观察两个实验过程中现象的差异,依据现象得出结论,这个过程中分别运用了实验法、观察法、比较法来研究金属钠的性质,没有涉及的是分类法。2.(2019·合肥高一检测)研究物质的物理性质时,最常用到的方法是()A.观察B.实验C.假说D.模型【解析】选A。研究物质的颜色、状态、气味、溶解性等物理性质经常用到的方法是观察法。3.(2019·聊城高一检测)从生活常识角度考虑,试推断钠元素在自然界中存在的主要形式是()A.NaB.NaClC.NaOHD.Na2O【解析】选B。Na能与空气中的氧气、水反应;NaOH能与空气中的CO2反应;Na2O能与空气中的CO2、水反应,所以都不能稳定存在。4.(2019·武威高一检测)下列物质中,有一种物质的颜色与其他三种物质的不同,这种物质是()A.NaOHB.Na2OC.Na2O2D.Na2CO3【解析】选C。Na2O2为淡黄色固体,其他三种皆为白色固体。5.(2019·潍坊高一检测)将一块银白色的金属钠放在空气中会发生一系列的变化:表面迅速变暗“出汗”变成白色固体(粉末),下列有关叙述正确的是()A.表面迅速变暗是因为钠与空气中的氧气反应生成了过氧化钠B.“出汗”是因为生成的氢氧化钠吸收空气中的CO2在表面形成了溶液C.最后变成碳酸钠粉末D.该过程的所有变化均为化学变化【解析】选C。钠露置在空气中迅速变暗,是因为Na与O2反应生成了Na2O,Na2O与水反应生成NaOH,NaOH潮解在表面形成NaOH溶液而“出汗”,NaOH溶液又吸收空气中的CO2,生成Na2CO3·10H2O,Na2CO3·10H2O逐渐风化脱水,最后变成Na2CO3粉末,该过程中NaOH的潮解不属于化学变化。二、非选择题(本题包括1小题,共10分)6.(改编题)2018年4月12日上午,中央军委在南海海域隆重举行海上阅兵,展示人民海军崭新面貌,激发强国强军坚定信念。潜艇兵是我国海军的一个重要兵种,肩负着保卫祖国海洋、保卫人民的重担。在潜水艇中可用过氧化钠作为供氧剂。请选用适当的化学试剂和实验用品,用如图的实验装置进行实验,证明过氧化钠可作供氧剂,其中A是实验室制取CO2的装置。(1)请分析装置B、C、D中所加的试剂及其作用或目的。仪器加入试剂加入该试剂的作用或目的BCD提示:仪器加入试剂加入该试剂的作用或目的B饱和NaHCO3溶液除去CO2中混有的HClCNa2O2反应生成O2DNaOH溶液吸收没有反应的CO2(2)怎样检验反应生成的气体是氧气?提示:将试管F从水槽中取出,用带火星的木条放在试管口处,木条复燃,则证明该气体是氧气。【补偿训练】1.(2019·洛阳高一检测)金属钠是在1807年通过电解氢氧化钠制得的,这个原理应用于工业生产,约在1891年才获得成功。1921年实现了电解氯化钠制钠的工业方法,其反应原理是2NaCl(熔融)2Na+Cl2↑。回答下列有关单质钠的问题:(1)下列各项中属于保存金属钠的正确方法是________。A.放在棕色瓶中B.放在细沙中C.放在水中D.放在煤油中(2)将一小块钠放在水平放置的试管中部,用酒精灯加热充分反应(如图Ⅰ所示),请写出该反应的化学方程式____________________________,生成物的颜色为________。将该试管冷却后直立,滴加几滴水(如图Ⅱ所示),发生反应的化学方程式为____________,检验该反应产生的气体的方法是__________________。(3)Na、Na2O、Na2O2、NaOH久置空气中最终都是变为________________(填化学式);过氧化钠与CO2反应的化学方程式____________________。因此,过氧化钠可作为呼吸面具和潜水艇的氧气来源。(4)一小块金属钠投入CuCl2溶液中,发生反应的方程式为_______________。【解析】(1)钠是很活泼的金属元素,其单质极易与水或氧气反应,又因为钠的密度小于水而大于煤油,因此钠通常保存在煤油中,答案选D。(2)将一小块钠放在水平放置的试管中部,加热,反应方程式为2Na+O2Na2O2,过氧化钠为淡黄色固体。将该试管冷却后直立,滴加几滴水,发生反应的化学方程式为2Na2O2+2H2O4NaOH+O2↑。用带火星木条靠近试管口,看是否复燃,可检验氧气的存在。(3)Na、Na2O、Na2O2、NaOH久置空气中最终都是变为碳酸钠,化学式为Na2CO3;过氧化钠与CO2反应生成碳酸钠和氧气,反应的化学方程式为2Na2O2+2CO22Na2CO3+O2,因此,过氧化钠可作为呼吸面具和潜水艇的氧气来源。(4)一小块金属钠投入CuCl2溶液中,首先与水反应生成氢氧化钠和氢气,然后氢氧化钠与氯化铜发生复分解反应,发生反应的方程式为2Na+CuCl2+2H2OCu(OH)2↓+H2↑+2NaCl。答案:(1)D(2)2Na+O2Na2O2淡黄色2Na2O2+2H2O4NaOH+O2↑用带火星木条靠近试管口,若木条复燃,则生成气体为O2(3)Na2CO32Na2O2+2CO22Na2CO3+O2(4)2Na+CuCl2+2H2OCu(OH)2↓+H2↑+2NaCl2.(2019·衡水高一检测)为了探究金属钠及其化合物的性质,甲乙丙三位同学分别作了如下三个实验:(1)甲同学在如图所示的平底烧瓶内(烧瓶内的空气已干燥)加入一小块金属钠。一段时间后甲同学可观察到什么现象?请你简述理由。提示:钠表面变灰暗,气球膨胀。因为钠与空气中的氧气发生反应4Na+O22Na2O,生成的Na2O为白色固体,因此钠表面变灰暗,同时烧瓶内压强降低,气球会膨胀。(2)乙同学用如图所示装置测定空气里氧气的含量。先用弹簧夹夹住橡胶管。点燃钠,伸入瓶中并塞上瓶塞。待钠熄灭并冷却后,打开弹簧夹,观察瓶内水面变化情况。①简述上述实验的原理,并预测可能出现的现象。提示:钠与空气中的氧气反应,导致瓶内压强减小,使烧杯中的水进入瓶中,如果金属钠充足,进入瓶中的水约占瓶体积的。②实验完毕,如果瓶内水面上升明显小于瓶内空气体积的,请分析原因。提示:金属钠的量不足,瓶内氧气没有消耗完;或者装置的气密性不好,导致钠熄灭冷却时外界空气进入瓶内等。(3)丙同学实验探究钠加热与空气中氧气的反应。①用坩埚钳夹持坩埚放在三脚架的泥三角上,用小刀切下绿豆粒大小的钠块,用滤纸吸干煤油后放入坩埚中。②点燃酒精灯进行加热。③观察现象并记录生成固体的颜色。请回答丙同学观察到的实验现象,并写出反应的化学方程式。提示:钠受热先熔化成闪亮的小球,然后剧烈燃烧,火焰呈黄色,生成一种淡黄色固体。发生反应的化学方程式为2Na+O2Na2O2一、选择题(本题包括1小题,共6分)7.下列说法正确的是()A.切开的金属Na暴露在空气中,光亮表面逐渐变暗:2Na+O2Na2O2B.钠与盐酸或水反应的反应实质相同C.常温下Na与足量O2反应生成Na2O,随温度升高生成Na2O的速率逐渐加快D.Na的金属活动性比Mg强,故可用Na与MgCl2溶液反应制Mg【解析】选B。切开的金属钠在空气中变暗是因为Na与空气中的O2反应生成Na2O,反应的化学方程式为4Na+O22Na2O,选项A错误;钠与水、盐酸反应的实质都是与H+反应,B正确;常温下Na与足量O2反应生成Na2O,随温度升高生成Na2O2,选项C错误;钠的金属性很强,极易和水反应,不能用Na与MgCl2溶液反应制Mg,选项D错误。【补偿训练】1.(2019·佛山高一检测)在烧杯中加水和苯(苯的密度为0.8g·cm-3,与水互不相溶,且不与钠反应)各50mL,将一小粒金属钠(密度0.97g·cm-3)投入烧杯中,观察到的现象可能为()A.钠在水层中反应并四处游动B.钠停留在苯层中不发生反应C.钠在苯的液面上反应并四处游动D.钠在苯与水的界面处反应并可能上下跳动【解析】选D。苯与水互不相溶,还有钠的密度处于苯和水之间,钠能与水反应而不与苯反应。另外钠与水反应放出的氢气使钠在苯和水的界面处反应时可能上下跳动。2.下列实验操作中,溶液里无固体析出的是()A.CuCl2溶液中加入Na2O粉末B.Ca(OH)2饱和溶液中加入Na的小颗粒C.Mg(NO3)2溶液中加入Na2O2粉末D.水中加入Na的小颗粒【解析】选D。A项,生成Cu(OH)2沉淀;B项,Na与水反应消耗水且反应放热,析出Ca(OH)2固体;C项,生成Mg(OH)2沉淀;D项,Na与水反应生成NaOH溶液,不析出固体。3.(2019·石家庄高一检测)将钠和炭分别置于如图所示的两个盛满氧气的集气瓶中,燃烧完毕冷却至室温后,打开装置中的两个活塞,这时观察到()A.水进入左瓶B.水进入右瓶C.水同时进入两瓶D.水不进入任何一瓶【解析】选A。钠燃烧消耗氧气,左侧压强减小。炭燃烧生成CO2,压强不变。所以水应该进入左瓶。二、非选择题(本题包括1小题,共14分)8.(原创题)为解决养鱼的增氧问题,可在水中加入过氧化钙(CaO2)作制氧剂。过氧化钙溶于水中能放出氧气,增加水体中的溶氧量,用于防止鱼池水体缺氧和鱼池缺氧急救,还可用于鱼类越冬池安全及鱼苗、活鲜鱼运输。(1)根据Na2O2的化学性质,预测CaO2可能具有怎样的化学性质。提示:CaO2能与水或二氧化碳反应生成氧气。(2)根据Na2O2与H2O、CO2反应的化学方程式,写出CaO2与H2O、CO2反应的化学方程式。提示:2CaO2+2H2O2Ca(OH)2+O2↑、2CaO2+2CO22CaCO3+O2。【补偿训练】现用金属钠和空气制备纯度较高的Na2O2,可利用的装置如图所示。回答下列问题(注:Na2O2可以与H2O、CO2发生反应):(1)装置Ⅳ中盛放的药品是________,其作用是___________________。(2)若规定气体的气流方向从左到右,则组合实验装置时各仪器的正确连接顺序为______________________(按从左到右顺序写明仪器的编号Ⅰ、Ⅱ……),各仪器接口的连接顺序是:空气进入________,______接______,________接________,________接________(填字母序号)。(3)装置Ⅱ的作用为__________________________________________。(4)操作中通空气和加热的顺序为______________________________。【解析】用金属钠和空气制备纯度较高的Na2O2的过程中,要避免生成的Na2O2与空气中的水蒸气和二氧化碳发生反应,在制取过程中导入空气时要除去这两种杂质,且最后要防止外界空气中的水蒸气和二氧化碳进入反应装置。答案:(1)氢氧化钠溶液吸收导入的空气中的二氧化碳(2)Ⅳ、Ⅲ、Ⅰ、Ⅱhgfeabc(3)防止空气中的水蒸气和二氧化碳进入装置Ⅰ(4)先通一段时间的空气后再加热装置Ⅰ




 三七文档所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。
三七文档所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。
本文标题:2019-2020新教材高中化学 课时素养评价一 1.2.1 研究物质性质的基本方法(含解析)鲁科版
链接地址:https://www.777doc.com/doc-7960280 .html