当前位置:首页 > 临时分类 > 《化学反应与热能第一课时教案》
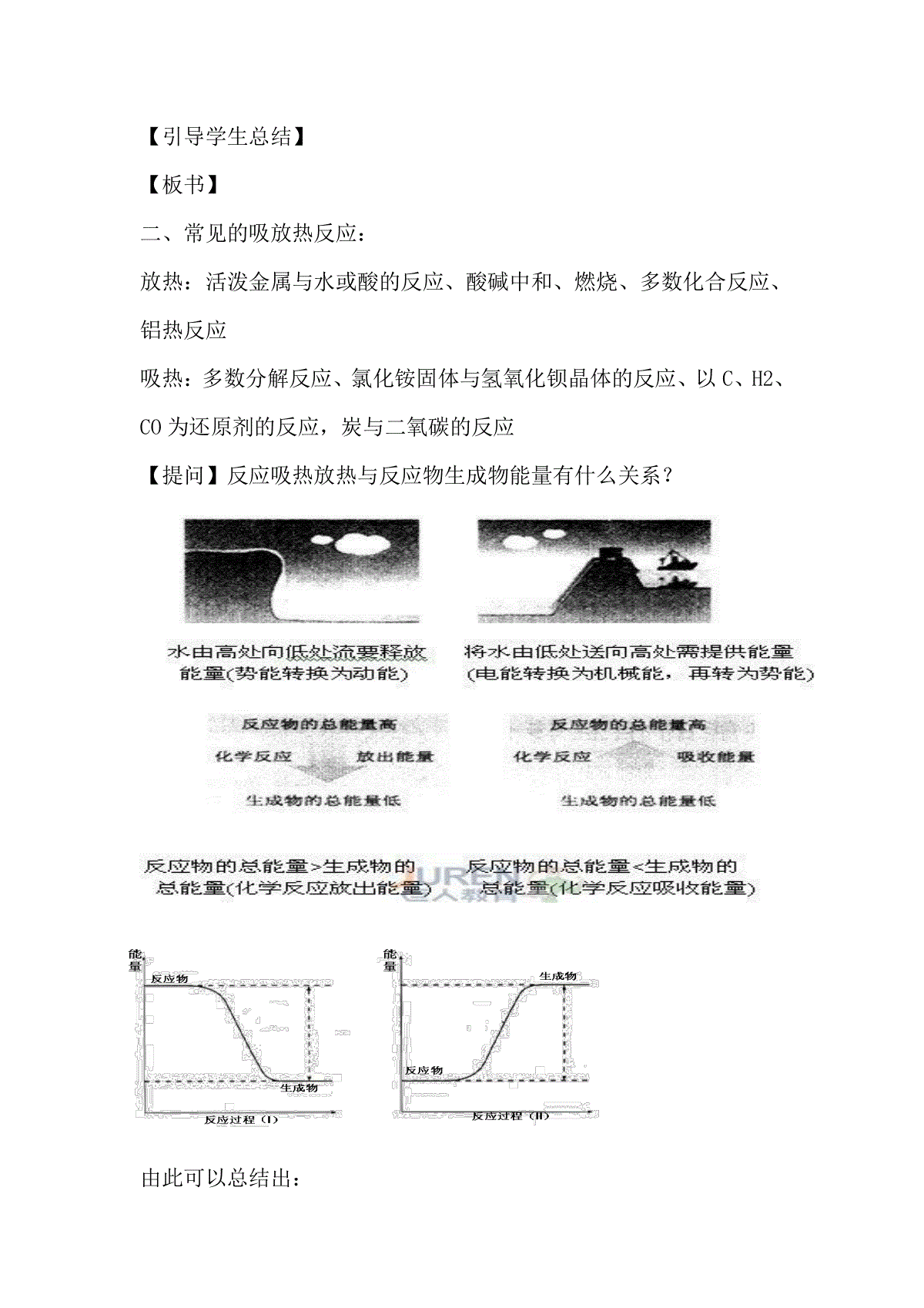
化学反应与热能(第一课时)一、教学目标:(一)知识与技能:1、了解化学反应中能量转化的原因和常见的能量转化形式;2、了解吸热放热反应的种类并通过反应物生成物的能量及键能判断吸热放热反应;3、掌握反应热和焓变;4、掌握热化学方程式的书写。(二)过程与方法:1、从化学反应的本质研究反应热产生的原因;2、学习用图表表示化学反应放出能量和吸收能量的方法,培养学生阅读图表的能力;3、从本质掌握热化学方程式的书写技巧。(三)情感态度与价值观:1、了解简单过程中的能量变化中的热效应;2、从本质上(微观角度)理解化学反应中能量的变化,建立科学的能量变化观。二、教学重难点教学重点:反应热的变化;热化学方程式的书写教学难点:反应热的变化;热化学方程式的书写三、教学过程:【讲解】我们在初中学习过“质量守恒定律,知道自然界中物质可以相互转化,但是总质量保持不变;同样一种能量可以转化成另一种能量,能量也是守恒的,“质量守恒定律”和“能量守恒定律”是两条基本的自然定律,化学反应过程中化学能同样可转化成其他形式的能量,如热能、电能等。【投影】举例【讲解】化学反应的过程中伴随着能量变化,通常表现为热量的变化,今天我们学习化学反应与热能的关系。【板书】化学反应与热能【提问】反应中的热量由何而来?【讲解】我们从化学键角度分析化学反应导致能量变化的本质,以氢气和氯气反应为例。讲述:化学反应的本质是反应物中化学键的断裂和生成物中化学键的形成。断开反应物中的化学键需要吸收能量,形成生成物中的化学键要放出能量。氢气和氯气反应时,氢气分子和氯气分子中的H—H键和Cl—Cl键断开,氢原子和氯原子通过形成H—Cl键而结合成HCl分子。1molH2中含有lmolH—H键,1molCl2中含有1molCl—Cl键,在25℃和101kPa的条件下,断开1molH—H键要吸收436kJ的能量,断开1molCl—Cl键要吸收242kJ的能量,而形成1molHCl分子中的H—Cl键会放出431kJ的能量。断开1molH—H键和1molCl—Cl键吸收的能量小于形成2molH—Cl键放出的能量,根据“能量守恒定律”,多余的能量就会以热量的形式释放出来。因此这个反应是一个放热反应。【提问】化学反应中能量变化的实质是什么?【学生回答】化学键的断裂和形成。【板书】一、化学反应中能量变化的实质:化学键的断裂和形成【提问】反应吸热放热与反应物生成物键能有什么关系?【总结】断裂化学键要吸收能量,形成新化学键要放出能量,若断裂化学键吸收的能量大于形成新化学键放出的能量,则反应吸热;若断裂化学键吸收的能量小于形成新化学键放出的能量,则反应放热。【板书】断裂吸热成键放热,反应吸热;断裂吸热成键放热,反应放热。【讲解】高一时曾做过铝片与盐酸、氢氧化钡与氯化铵晶体的反应实验。在这两个实验当中,能量有哪些变化?总结在我们学过的化学反应当中,分别有哪些吸热放热反应?铝片与盐酸是放热反应,氢氧化钡与氯化铵晶体是吸热反应。【引导学生总结】【板书】二、常见的吸放热反应:放热:活泼金属与水或酸的反应、酸碱中和、燃烧、多数化合反应、铝热反应吸热:多数分解反应、氯化铵固体与氢氧化钡晶体的反应、以C、H2、CO为还原剂的反应,炭与二氧碳的反应【提问】反应吸热放热与反应物生成物能量有什么关系?由此可以总结出:【板书】反应物具有的总能量生成物具有的总能量,则反应放热反应物具有的总能量生成物具有的总能量,则反应吸热【板书】三、反应热与焓变【讲解】化学反应过程中所释放或吸收的能量,都可以热量的变化来表述,叫做反应热,恒温恒压下的反应热与“焓变”相等。【板书】1、定义符号:ΔH,单位:kJ/mol或kJ•mol-1【思考】如何计算反应热?规定放热反应的ΔH为“-”,是站在谁的角度?【板书】2、计算∆H=E(生成物的总能量)-E(反应物的总能量)或∆H=E(反应物的键能)-E(生成物的键能)放热反应ΔH为“—”或ΔH〈0吸热反应ΔH为“+”或ΔH〉0例如:H2(g)+Cl2(g)2HCl(g)实验测的1molH2与1molCl2反应生成2molHCl时放出184.6KJ的热量,反应热的计算:(1)化学键断裂时需要吸收能量,吸收总能量为:436KJ+243KJ=679KJ(2)化学键形成时需要释放能量,释放总能量为:431KJ+431KJ=862KJ(3)反应热的计算:862KJ—679KJ=183KJ【投影】例1、1molC与1molH2O(g)反应生成1molCO(g)和1molH2(g),需吸收131.5KJ的热量,该反应的反应热为△H=KJ/mol。例2、拆开1molH—H键、1molN—H键、1mol分别需要的能量是436KJ、391KJ、946KJ,则1molN2生成NH3的反应热为;1molH2生成NH3的反应热为。【思考】反应热与反应物生成物的稳定性有什么关系?【提示】物质所具有的总能量越高物质越不稳定,如人站在低处稳定,有安全感;水趋向于向低处流,物质都趋于稳定的状态。【归纳总结】若反应放热,说明反应物所具有的总能量生成物所具有的总能量△H0反应物的稳定性生成物的稳定性若反应吸热,说明反应物所具有的总能量生成物所具有的总能量△H0反应物的稳定性生成物的稳定性【板书】3、反应热与反应物、生成物稳定性的关系(1)能量越低越稳定(2)若反应放热,反应物的稳定性生成物的稳定性若反应吸热,反应物的稳定性生成物的稳定性【讲解】热化学方程式如何书写?【板书】四、热化学方程式的书写【板书】1、定义:表明反应所放出或吸收的热量的化学方程式,叫做热化学方程式。2、意义:不仅表明了化学反应中的物质变化,也表明了化学反应中的能量变化。3、书写步骤:(1)写出化学方程式;(2)标明各物质的聚集状态;【讲解】书写热化学方程式要注明物质的聚集状态,因为物质呈现哪一种聚集状态(气、液、固)与他们所具有的能量有关。例如:水蒸气状态时所具有的能量与液态或固态时所具有的能量是不同的。(3)注明反应的温度和压强(中学阶段可不特别注明);(4)写出△H的值并标明“+”与“—”以及单位;(5)检查化学计量数和△H值是否对应。【讲解】化学计量数与△H的关系:1、热化学方程式中,物质前的化学计量数不表示微粒个数而表示物质的量。它可以是整数,也可以是分数;2、对于同一个反应,△H与化学计量数成正比。例如:H2(g)+Cl2(g)=2HCl(g);△H=—184.6KJ/mol1/2H2(g)+1/2Cl2(g)=HCl(g);△H=—92.3KJ/mol2H2(g)+O2(g)=2H2O(g);△H=—483.6KJ/molH2(g)+1/2O2(g)=H2O(g);△H=—241.8KJ/mol【讲解】热化学方程式的含义是什么?热化学方程式描述在一定条件下,一定量某状态下的物质,充分反应后所吸收或放出热量的多少。例如:H2(g)+1/2O2(g)=H2O(g);△H=—241.8KJ/mol,表示1mol气态H2和1/2molO2例题1、当1mol气态H2与1mol气态Cl2反应生成2mol气态HCl,放出184.6KJ的热量,请写出该反应的热化学方程式。2.写出下列反应的热化学方程式1)1molN2(g)与适量O2(g)反应生成NO(g),需吸收68kJ的热量;2)2molCu(s)与适量O2(g)反应生成CuO(s),放出314kJ热量;3)1g硫粉在氧气中充分燃烧放出9.36kJ热量,写出硫燃烧的热化学方程式。反应生成1mol水蒸气,放出241.8KJ的热量。(在101Kpa,25℃时)四、板书设计化学反应与热能一、化学反应中能量变化的实质:化学键的断裂和形成断裂吸热成键放热,反应吸热;断裂吸热成键放热,反应放热。二、常见的吸放热反应:放热:活泼金属与水或酸的反应、酸碱中和、燃烧、多数化合反应、铝热反应吸热:多数分解反应、氯化铵固体与氢氧化钡晶体的反应、以C、H2、CO为还原剂的反应,炭与二氧碳的反应反应物具有的总能量生成物具有的总能量,则反应放热反应物具有的总能量生成物具有的总能量,则反应吸热三、反应热与焓变1、定义化学反应过程中所释放或吸收的能量叫做反应热,恒温恒压下的反应热与“焓变”相等。符号:ΔH,单位:kJ/mol或kJ•mol-12、计算∆H=E(生成物的总能量)-E(反应物的总能量)或∆H=E(反应物的键能)-E(生成物的键能)放热反应ΔH为“—”或ΔH〈0吸热反应ΔH为“+”或ΔH〉03、反应热与反应物、生成物稳定性的关系(1)能量越低越稳定(2)若反应放热,反应物的稳定性生成物的稳定性若反应吸热,反应物的稳定性生成物的稳定性四、热化学方程式的书写1、定义:表明反应所放出或吸收的热量的化学方程式,叫做热化学方程式。2、意义:不仅表明了化学反应中的物质变化,也表明了化学反应中的能量变化。3、书写步骤:(1)写出化学方程式;(2)标明各物质的聚集状态;(3)注明反应的温度和压强(常温常压可不特别注明);(4)写出△H的值并标明“+”与“—”以及单位;(5)检查化学计量数和△H值是否对应。




 三七文档所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。
三七文档所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。
本文标题:《化学反应与热能第一课时教案》
链接地址:https://www.777doc.com/doc-8036729 .html