当前位置:首页 > 行业资料 > 其它行业文档 > 无机化学-第2章化学键与物质结构
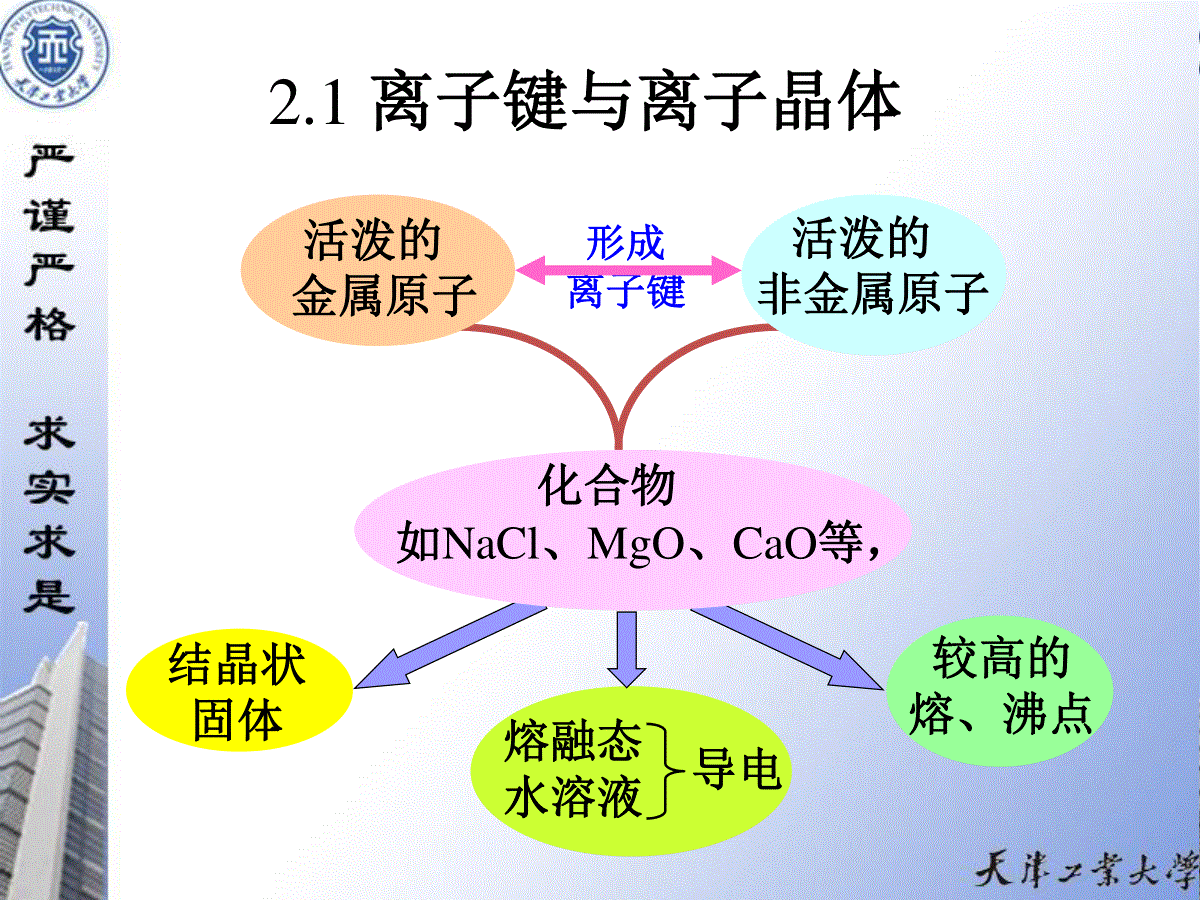
第2章化学键与物质结构化学键是讨论分子或晶体中相邻原子或离子之间的结合方式。根据分子或晶体中电子的运动方式不同,化学键分为离子键、共价键和金属键。物质由分子组成,分子是保持物质性质的最小微粒,也是物质参与化学反应的基本单元。研究物质性质及其变化的根本原因,必须进一步研究物质的微观结构,研究物质的微观结构就是研究物质的分子结构。分子结构包含的几个方面:(3)分子之间的弱相互作用力,包括范德华力和氢键作用力;(1)分子中直接相邻的原子或离子间的强相互作用力,即化学键;(2)分子中的原子或离子在空间的排列,即空间构型,也称几何构型;(4)分子的结构与物质性质的联系。本章主要内容2.1离子键与离子晶体2.2共价键与共价晶体2.3配位键和配位化合物2.4金属键与金属晶体2.5分子间作用力、氢键和分子晶体2.6混合型晶体2.1离子键与离子晶体活泼的金属原子活泼的非金属原子化合物如NaCl、MgO、CaO等,结晶状固体较高的熔、沸点形成离子键熔融态水溶液导电2.1.1离子键理论1.离子键的形成nNa(3s1)nNa+(2s22p6)-ne-nCl(3s23p5)nCl-(3s23p6)+ne-静电作用nNa+Cl-形成条件:x>1.72.离子键的特征没有方向性在离子型化合物中,一个离子对它周围所有电荷相反的离子有相同的吸引力。原因:离子的电荷分布具有球形对称的结构,阴、阳离子之间可从各个方向相互接近形成离子键。没有饱和性在形成离子键时,只要空间条件允许,离子尽可能多的吸引电荷相反的离子,不受离子本身所带电荷的限制。如NaCl晶体中,每个Na+周围有6个Cl-,同时,每个Cl-周围也有6个Na+。3.离子的结构1)离子的电荷数在形成离子键时,原子在达到8电子(或2电子)结构形成离子时失去或得到的电子数。正、负离子的电荷数主要取决于相应原子的核外电子排布、电离能和电子亲和能等离子电荷越高,对相反电荷离子的静电引力越强,因而化合物的熔点就越高。如CaO的熔点(2590℃)比KF的熔点(856℃)要高得多。离子的电荷是影响离子化合物性质的重要因素2)离子半径离子半径是根据晶体中相邻正、负离子的核间距测出的,核间距可以看作是正、负两个相邻离子的半径之和。离子半径具有的规律:主族元素从左到右,离子半径依次减小。自上而下,离子半径依次增大。(1)同一周期:(2)同一主族元素:负离子所带电荷数越多,离子半径越大;半径较小的离子所形成的离子键的核间距小,正、负离子的吸引作用大,形成的离子化合物的熔沸点高、硬度大。(3)同一元素:负离子半径大于原子半径,正离子半径小于原子半径,正离子所带电荷数越多,离子半径越小;阴离子:ns2np68电子构型价电子分布式1s2实例Li+Be2+ns2np6Na+Mg2+Al3+ns2np6nd1~9Cr3+Mn2+Fe2+ns2np6nd10Ag+Zn2+Hg2+(n-1)s2(n-1)p6(n-1)d10ns2Sn2+Pb2+Bi3+正离子的电子构型有以下几种:电子构型289~171818+23)离子的电子构型4.离子键的强度1)用离子键的键能表示在298.15K和标准态下,将气态离子化合物1mol离子键断开使其分解成气态中性原子(或原子团)时所需要的能量,称为该离子键的键能。离子键的键能越大,键的稳定性越高。mrHNaCl(g)=Na(g)+Cl(g)=398kJ·mol-12)用离子晶体的晶格能表示在标准态下将1mol离子型晶体(如NaCl)拆散为1mol气态阳离子(Na+)和1mol气态阴离子(Cl-)所需要的能量,用符号U表示,单位为kJ·ml-1。离子晶体的硬度越大,熔点越高。U是衡量离子键强度的标志:U能越大,离子键强度就越大,熔化或破坏离子晶体时消耗的能量也就越多,(1)玻恩—哈伯循环法Na(s)+Cl2(g)NaCl(s)21△fHmNa(g)Cl(g)+eCl-(g)E1Cl–eNa+(g)+S升华I1Na-UNa-Cl21DCl-Cl=S升华+I1Na+DCl-Cl21+E1Cl-UNaClmfH+DCl-Cl21mfH+DCl-Cl21=S升华+I1Na+E1Cl-UNaClmfH=106+495.8+121.3+(-348.7)–(-411)=785.4(kJ·mol-1)=S升华+I1Na+DCl-Cl21+E1Cl-UNaClmfH+DCl-Cl21mfH(2)玻恩—郎德公式U=1.38940×105(1-)n1Z+Z-ARoA、n可从手册中查到Z+、Z-正、负离子电荷数的绝对值Ro正、负离子间的距离(r++r-)/pmA马德龙常数n玻恩指数(与离子电子构型有关)晶格类型CsClNaClZnSA1.7631.7481.638离子的电子构型HeNeAr或Cu+Kr或Ag+Xe或Au+n1)5791012AB型离子的马德隆常数和波恩指数1)如果正、负离子属于不同电子构型,n取两种类型的平均值例如NaCl晶体中,R0=95+181=276(pm),Z+=Z-=1,A=1.748,n=1/2(7+9)=8,)mol770(kJ)811(276748.1111038940.11-5U影响离子晶体晶格能的因素:离子半径→小,电荷数→高,正、负离子吸引力→大,晶格能越大,晶体越稳定。破坏晶体能量,多例题2-1试比较下列3组化合物的熔点。(1)NaF与NaCl(2)MgO与CaO(3)NaF与CaO(二者离子半径和接近)(2)Mg2+比Ca2+半径小,所以MgO熔点高;解:(1)Cl-比F-半径大,所以NaF熔点高;(3)Ca2+、O2-比Na+、F-电荷高。所以CaO熔点高。2.1.2离子晶体1.晶体的基本知识(1)有一定的几何形状食盐立方体方解石棱面体非晶体没有一定的几何外形无定形体六角柱体石英如玻璃、石蜡等由极微小晶体组成的物质称为微晶体。如炭墨和化学反应刚析出的沉淀等。1)晶体的特征(2)有固定的熔点(3)各向异性晶体光学性质原因:①晶粒的排列有次序、有规律力学性质导热、导电性溶解性不同方向测定结果不同②按某些确定的规则重复地排列非晶体没有固定的熔点,只有一段软化的温度范围。非晶体是各向同性(微粒排列无次序、不规律)如松香在50~70℃之间软化2)晶体的内部结构结点:沿一定的方向按某种规则把结点连接起来,晶体中规则排列的微粒抽象为几何学中的点晶格:晶格中,能表现出其结构的一切特征的最小部分。晶胞:得到的描述各种晶体内部结构的几何图象。点阵结点的总和用六个常数(参数)描述:Cabαβγa、b、cα、β、γ晶胞的特征Cl-Cl-Cl-Cl-Cl-Na+Na+Na+Na+晶胞在三维空间中的无限重复晶格七种晶系的性质晶系边长角度实例立方晶系四方晶系六方晶系菱形晶系正交晶系单斜晶系三斜晶系a=b=ca=b≠ca=b≠ca=b=ca≠b≠ca≠b≠ca≠b≠cα=β=γ=90°α=β=γ=90°α=β=90°γ=120°α=β=γ≠90°(<120°)α=β=γ=90°α=β=90°γ>90°α≠β≠γ岩盐(NaCl)白锡石墨方解石斜方硫单斜硫重铬酸钾14种布拉维晶格七种晶系带心型式分类晶体晶胞参数差异七种晶系十四种布拉维晶格体心立方面心立方简单菱形简单四方体心四方简单六方简单正交体心正交底心正交面心正交简单单斜底心单斜简单三斜简单立方3)晶体的基本类型各类晶体的内部结构及性质特征CO2I2易溶于非极性溶剂非导体很弱很软分子间力非极性分子WAgCuHClNH3金刚石SiCNaClMgO实例不溶性易溶于极性溶剂不溶性易溶于极性溶剂溶解性良导体固态、液态不导电,水溶液导电非导体熔融态及其水溶液导电导电导热性有延展性弱很脆脆机械性质软很硬硬硬度低很高高熔、沸点金属键分子间力氢键共价键离子键结合力原子、正离子极性分子原子正、负离子结点上的粒子金属晶体分子晶体共价晶体离子晶体晶体类型很低较高(Hg例外)软、硬不一样2.离子晶体中最简单的结构类型结构类型NaCl型CsCl型ZnS型配位数684配位比6:68:84:4晶胞形状正立方体正立方体正立方体晶格类型面心立方体心立方立方六方实例KILiFNaBrMgOCaSTiClCsBrCsIAgIAgIZnSZnO晶体结构3.离子晶体的半径比定则正离子负离子配位数为六时离子晶体的某一层令r-=1,则ac=4ab=bc=2+2r+∵△abc为直角三角形则222bcabac42=(2+2r+)2+(2+2r+)2解得r+=0.414当r+/r-=0.414时,阴、阳离子之间刚好接触。abc如果r+/r-<0.414阴、阳离子不接触,阴离子保持接触。吸引力<排斥力E体系↑晶体向配位数减小的方向转变构型不稳定如果r+/r->0.414阴、阳离子保持接触,阴离子脱离接触。吸引力>排斥力E体系↓构型可以稳定存在。配位数为6的必要条件是r+/r-≥0.414当r+/r->0.732时,晶体将向配位数增大的构型转变正、负离子半径比与配位数关系r+/r-配位数构型0.225~0.4140.414~0.7320.732~1.00468ZnS型NaCl型CsCl型2.1.3离子极化及其对物质性质的影响1.离子的极化(a)无电场作用.·正离子负离子正、负电荷中心互重合不存在偶极(b)外加电场作用··+-+-—+正离子负离子离子发生变形产生诱导偶极离子的极化极化强度:离子的极化力,离子的变形性。1)离子的极化力离子使带相反电荷离子极化而发生变形的能力影响因素电荷数和电子构型相同时,离子的半径越小,产生的电场越强,极化力越大;例如:Mg2+>Ba2+,Na+>K+。离子半径相近,正离子的电荷数越高,产生的电场强度越大,极化力越强。例如:Si4+>Al3+>Mg2+>Na+。(1)离子的半径:(2)离子的电荷数:(3)离子的电子构型:电荷相同,半径相近时,电子构型:18+2,18,2>9~17>82)离子的变形性指离子被相反电荷极化而发生变形的能力电荷数和电子构型相同时,离子的半径越大,变形性越大;例如:I->Br->Cl->F-。大小电子构型相同时,负离子的电荷数越高,变形性越大;正离子的电荷数越高,变形性越小。下列离子的变形性顺序为:O2->F->(Ne)>Na+>Mg2+>Al3+>Si4+(1)离子的半径:(2)离子的电荷数:离子电荷相同,半径相近时,电子构型:18+2,18,9~17>8(3)离子的电子构型:最易变形体积大的阴离子18e、(18+2)e少电荷的阳离子最不易变形:半径小、电荷数多、稀有气体构型的阳离子。正离子的半径小,极化力大,变形性小;负离子半径大,极化力小,变形性大。正离子的极化力讨论离子极化负离子的变形性注意阳离子极化力大,变形性不大;对阴离子的极化作用大阴离子极化率大阴离子本身的变形性大阴离子对阳离子的极化可忽略3)离子的极化规律(1)负离子半径相同:时,正离子的半径越小,负离子被极化的程度越大,产生的诱导偶极越大。时,负离子半径越大,越容易被极化,产生的诱导偶极越大。阳离子对阴离子的极化作用规律正离子的电荷越多,负离子越容易被极化,产生的诱导偶极越大。(2)正离子电荷相同:(3)正离子电荷相同、半径相近:++2+3-+-+-+-+-+-++++-+-++++-+.+.+未极化极化.+-·+阴离子变形极化-·+-+·阳离子变形附加极化-+·-·+阴离子变形性增大阳离子阴离子易变形4)离子的附加极化离子价电子层中的d电子越多,电子层数越多,附加极化的作用就越强。2.离子极化对物质的结构和性质的影响1)离子极化对化学键类型的影响①阳离子+阴离子无极化离子键NaClCaCl2②阳离子+阴离子极化力强变形性大变形性大极化显著离子键共价键极化↑键极性↓··+-··+-+-····+-··卤化银的键型卤化银AgFAgClAgBrAgIX-的半径/pm136181195216r++r-/pm246277288299键型离子键过渡键型过渡键型共价键典型的离子键中含有一定的共价键成分,典型的共价键中含有部分的离子键成分。AgX的键型变化说明:离子键和共




 三七文档所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。
三七文档所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。
本文标题:无机化学-第2章化学键与物质结构
链接地址:https://www.777doc.com/doc-1839402 .html