当前位置:首页 > 建筑/环境 > 工程监理 > 高考复习-氮及其化合物
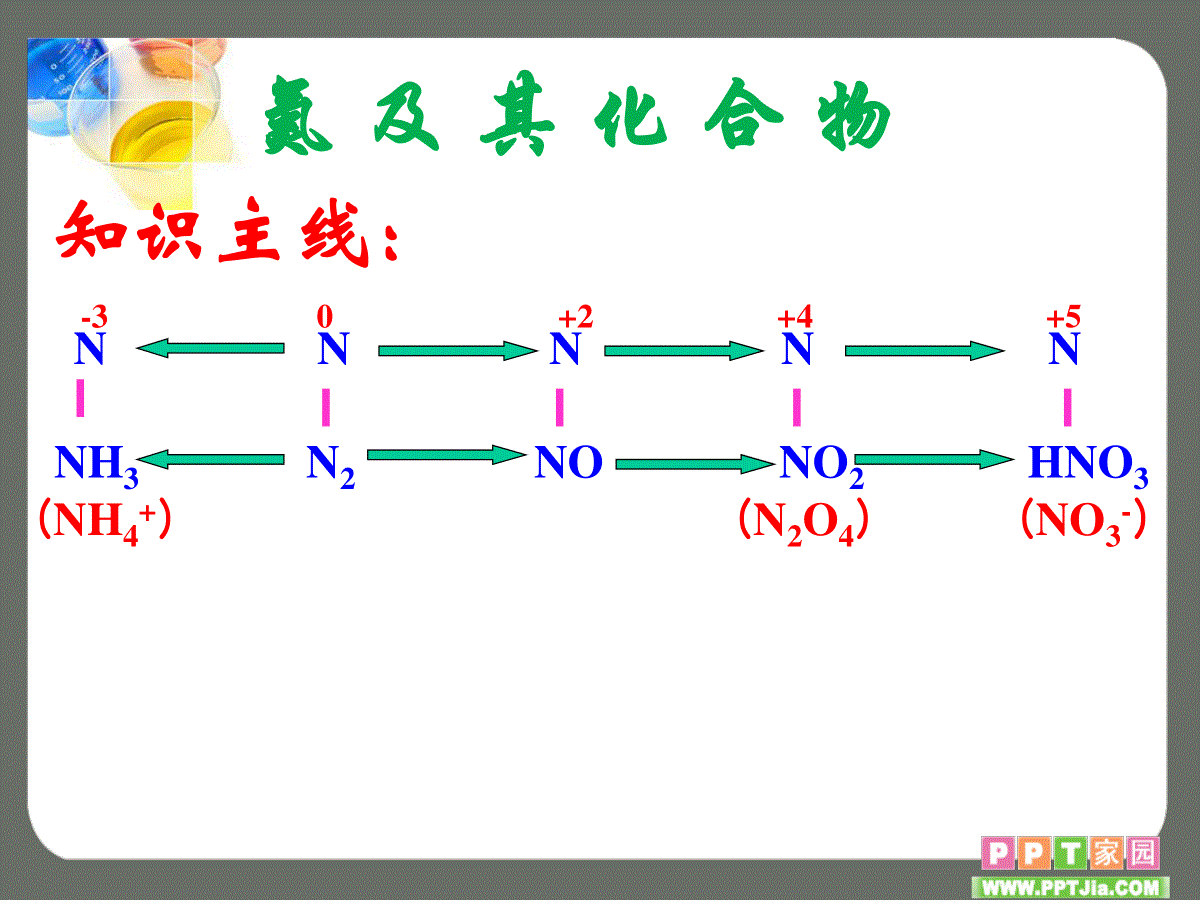
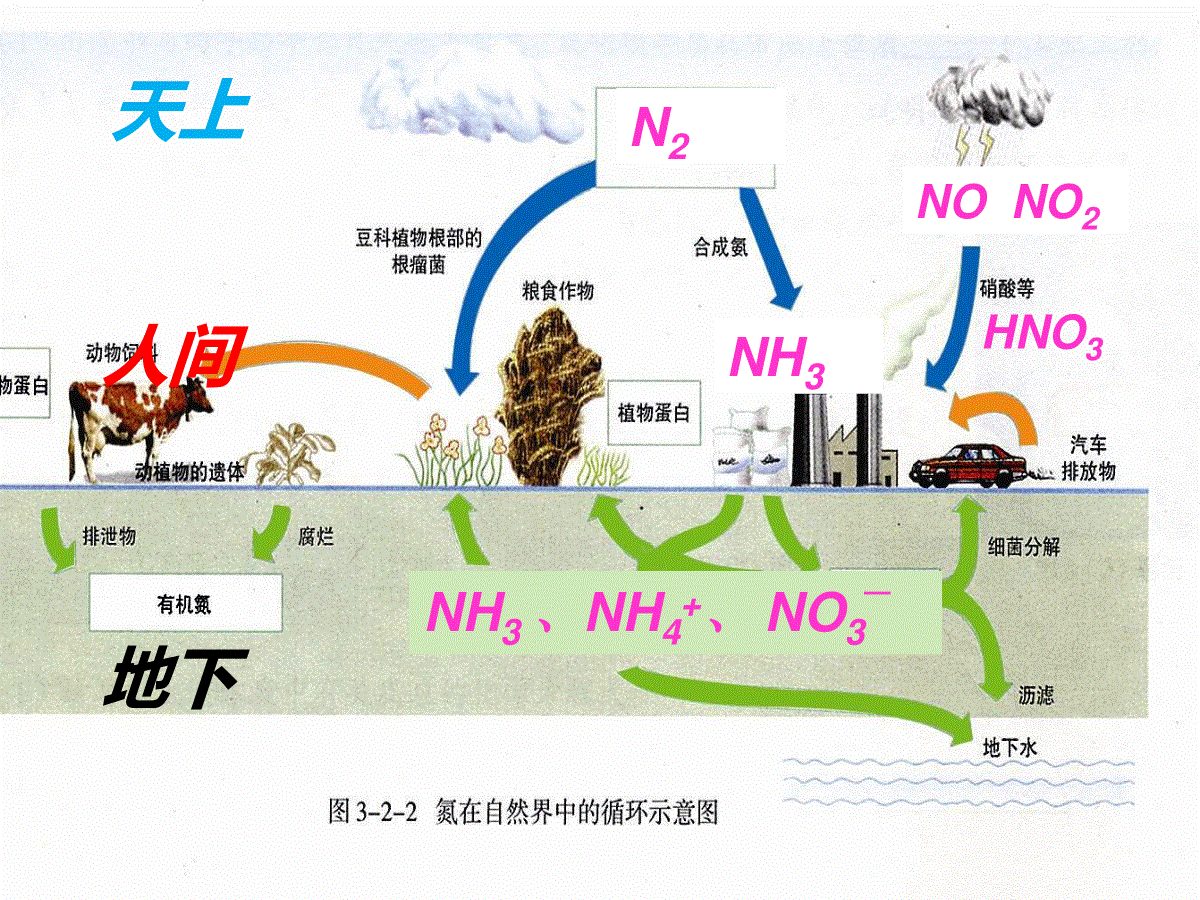
NHHH氮及其化合物知识主线:NNNNN-30+2+4+5NH3N2NONO2HNO3(NH4+)(N2O4)(NO3-)天上人间地下N2NONO2HNO3NH3NH3、NH4+、NO3—1.了解氮元素单质及其重要化合物的主要性质及其作用。2.了解氮元素单质及其重要化合物对环境质量的影响。本节重要知识有N2、NO、NO2、NH3、HNO3、铵盐的性质及用途,NH3的制法,NH+4的检验等,主要考查硝酸的强氧化性,如离子共存,氨气的性质、实验室制法及相关探究性实验,硝酸与金属反应的相关计算,大气污染等。硝酸的强氧化性一直是高考的热点,硝酸与金属的反应也经常出现,预测2018年的高考中氮及其化合物知识仍会与理论知识结合起来综合考查。非极性分子分子晶体物性难溶于水熔沸点很低无色无气味气体N≡NN2叁键(杂化方式?)化学性质用途常温:稳定(作保护气)高温:能反应(制NH3、HNO3)(放电)氧化性:和Mg、H2还原性:和O2氮的化合态固氮氮在自然界中的循环和对环境的影响氮气(填化学方程式)N2+O2=====放电或高温2NON2+3H2高温、高压催化剂2NH33Mg+N2=====点燃Mg3N2思考:1、为什么会有雷雨发庄稼、魔鬼谷?2、镁条在空气中燃烧的主产物是什么,为什么?3、氮化镁的电子式和与盐酸反应生成的盐有哪些?练习1:下列反应起了氮的固定作用的是()A、N2、H2在一定条件下反应生成NH3B、NH3经催化剂氧化生成NOC、NO与O2反应生成NO2D、由NH3制碳铵和硫铵2、298K时,合成氨反应的热化学方程式为:N2(g)+3H2(g)⇌2NH3(g)△H=-92.4kJ/mol.在该温度下取2molN2和6molH2放在一密闭容器中,在催化剂存在时进行反应,测得反应放出的热量()A、等于92.4kJB、等于184.8kJC、小于184.8kJD、大于184.8kJ转移电子数为NA关于固氮:植物只能利用化合态的氮,使空气中游离态的氮转化为含氮化合物的方法叫做氮的固定,简称固氮。氮的固定主要分为自然固氮和人工固氮。自然固氮的途径主要有两种:一种是通过闪电等产生含氮化合物的高能固氮,另一种是生物固氮(如根瘤菌),人工固氮有合成氨、仿生固氮等。氮在自然界中的循环和对环境的影响氮气的用途:(1)是合成氨、制硝酸的重要原料(2)保护气:焊接金属;灯泡的填充气体;保存粮食、罐头、水果(3)医学上,用液氮作冷冻剂。在常压下,液氮温度为-196℃,液氮(常写为LN2)(4)高科技领域中用液氮制造低温环境。空气降温加压液态蒸发N2O2N2制备:工业上:空气N2CO2N2C,△碱实验室:一种是将NH3通过灼热的CuO,另一方法:NH4Cl饱和溶液和NaNO2饱和溶液混合加热△NH4Cl+NaNO2NaCl+N2↑+2H2O2NH3+3CuON2+3Cu+3H2O△请写出氨气的电子式:请说出氨气分子的立体构型:氨气是极性分子还是非极性分子?氨气的熔沸点比PH3高还是低,为什么?列出氮族元素氢化物熔沸点高低顺序。氨气的结构和性质HH·NH·······孤对电子三角锥型氨气在水中的溶解度如何?在CCl4或苯中呢?氨气容易发生液化吗?为什么极易液化?利用这个性质,液氨可以用作那种用途?极性分子比PH3高,氨气分子之间能形成氢键。氨气极易溶于水,难溶于CCl4或苯。可用来防倒吸氨气易液化,液氨气化时吸收大量热,可用作制冷剂。1:700喷泉实验1.氨气的喷泉实验原理2.喷泉实验成败的关键(1)装置气密性要好;(2)烧瓶要干燥;(3)气体的纯度要大氨气极易溶于水,当烧瓶中的氨气溶于水时(喷泉装置中胶头滴管挤出的几滴水),烧瓶内的气体压强减小,形成烧瓶内外气体压强差,烧杯内的水在大气压作用下沿着导气管上升冲入烧瓶内而形成喷泉。气体HClNH3CO2SO2NO2和O2CH2=CH2吸收剂喷泉实验3.只要气体易溶于吸收剂,均可作喷泉实验。吸收剂可以是水,也可以是酸液、碱液等。如下列可用于作喷泉实验的试剂水NaOH溶液H2O溴水4.所得溶液的浓度计算某学生积极思考产生喷泉的其他方法,并设计了如图(II)所示的装置.①在图(II)的锥形瓶中,分别加入足量的下列物质,反应后可能产生喷泉的是D.A.Cu与稀盐酸B.NaHCO3与NaOH溶液C.Cu(NO3)2与稀硫酸D.NaHCO3与稀盐酸在图(II)锥形瓶外放一水槽,瓶中加入酒精,水槽中加入冷水后,再加入足量的下列物质,结果也产生了喷泉.水槽中加入的物质可能是.这种方法产生喷泉的原理是锥形瓶中的压强变大.A.浓硫酸B、食盐C.硝酸钾D.硫酸铜D.NaHCO3与稀盐酸A.浓硫酸下列装置能达到实验目的是()A.利用图1装置进行喷泉实验B.利用图2装置吸收HCl气体C.利用图3装置制备Cl2D.利用图4装置收集SO2气体A氨气的物理性质无色、有剌激性气味的气体比空气轻极易溶于水(1:700)易液化(可作致冷剂)熔沸点高(氢键)氨气的电子式:氨气的结构和性质氨气和酸反应的实质是什么?NH3分子有孤对电子,易通过配位键与H+结合形成NH4+。+H+[]+H据反应实质,解释氨水为什么是碱性的?NH3+H2ONH3·H2ONH4++OH-大部分小部分氨气可以使湿润的红色石蕊试纸变蓝,用此来检验氨气的存在。【问题】氨水中有哪些分子和离子?分子:离子:NH3、H2O、NH3·H2ONH4+、OH-、H+氨气溶于水时(氨气的水溶液叫氨水),大部分的NH3分子与H2O分子结合成NH3·H2O(一水合氨)。NH3·H2O为弱电解质。计算氨水的浓度时,溶质应为NH3。氨水的浓度越大,密度反而越小(是一种特殊情况)氨水的保存方法:氨水对许多金属有腐蚀作用,所以不能用金属容器盛装氨水。通常把氨水盛装在玻璃容器、橡皮袋、陶瓷坛或内涂沥青的铁桶里。氨基酸具有两性,氨基为什么具有碱性?请写出氨基酸(通式)与盐酸反应的化学方程式。氨气的结构和性质联氨(H2N-NH2)也叫肼,是重要的火箭燃料,它跟氨一样显碱性,能与酸反应生成盐。下列说法中不正确的是:()A.肼是二元碱B.肼具有还原性C.从键能分析,肼的热稳定性比氨强D.肼燃烧的产物是氮气和水C氨气的化学性质(1)与水反应:(2)NH3与酸的反应:NH3+H+==NH4+NH3与HCl反应NH3(g)+HCl(g)==NH4Cl(s)氨气和氯化氢气体接触,会产生白色的烟,可用来检验氨气或氯化氢是否泄漏。NH3与H2O、CO2反应:NH3+H2O+CO2=NH4HCO3(碳铵)氨气与挥发性(如盐酸、硝酸等)反应产生白烟NH3与难挥发性酸如H2SO4反应无白烟产生科学家在液氨中加入金属钠或金属锂制备NaNH2和LiNH2。工业上,NaNH2用于制取靛青染料;LiNH2主要用于有机合成和药物制造,是具有良好前景的储氢材料。2NH3+2Na=2NaNH2+H2氨气具有氧化性(氢元素体现)。氨气的结构和性质请分析氨气分子中两种元素的化合价,并以此推断氨气有哪些性质?氨气有没有还原性?与哪些物质反应可以体现出氨气的还原性?氨气的结构和性质氧化产物为什么不是NO2?氧化产物可以是氮气吗?(在纯氧中点燃)(工业制硝酸)(3)氨气的还原性:氨气的结构和性质NH3与Cl2能否反应?依据是什么?请标出反应过程中电子转移的方向和数目。设计实验验证上述反应中有电子转移。白色的烟雾!(氨气和氯气不能共存)2NH3+3CuO==N2+3Cu+3H2O加热(4)与某些盐反应Al3++3NH3·H2O==______________实验室制Al(OH)3,离子方程式常考题,氨水过量。Al(OH)3↓+3NH+4(5)形成配合物反应Mg2+、Fe2+、Fe3+、Zn2+、Cu2+、Ag+络合物,又称配位化合物,由中心原子或离子和若干个配位体分子或离子之间通过配位键结合形成的一类特殊的化合物。一般是过渡金属的离子,具有空轨道,如Fe2+、Fe3+、Cu2+、Ag+具有孤对电子的分子或离子,如Cl-、CN-、NH3、H2O、CO等Ag++2NH3·H2O=Ag(NH3)2++2H2OCu2++4NH3·H2O=Cu(NH3)42++4H2O银氨溶液(无色)铜氨溶液(深蓝色)氨气的结构和性质1、先进的潜艇推进器,可以提高潜艇的机动性和隐蔽性,从而大大提高作战性能。瑞典ASES公司设计用于驱动潜艇的液氨-液氧燃料电池示意图如下:写出负极的电极反应式:_________________2NH3-6e-+6OH-=N2+6H2O氨气的结构和性质2、NH3与F2以物质的量之比为4:3混合后,会冒白烟,同时生成另一种只含两种元素的气体M,则M的化学式为。NF33、工业上用NaClO与过量的NH3反应可以制备N2H4,同时生成一种钠盐和水,写出制备N2H4的反应方程式。NaClO+2NH3==N2H4+NaCl+H2O(NF3是制作高能激光化学反应器的原料。)N2H4是一种可燃性的液体,可用作火箭燃料。NH3还原性催化氧化NO(工业制硝酸)O2N2(燃料电池)Cl2NH4Cl(管道泄漏)NaClON2H4(火箭燃料)NOxN2(尾气处理)氧化性NaNH2LiNH2(药物合成)(储氢材料)液氨(致冷剂)铵盐(化肥)氨气的结构和性质(1)联氨(N2H4)水溶液显弱碱性,用离子方程式表示其原理。(2)工业上用NaClO与过量NH3反应可以制N2H4,为什么NH3要过量?(3)神舟十号火箭推进器常以联氨(N2H4)为燃料、四氧化二氮(N2O4)为助燃剂,燃烧生成无污染物质。写出燃烧的化学方程式。拓展应用:请写出联氨(N2H4)的电子式,并预测其性质2N2H4+N2O4=3N2+4H2O次氯酸钠具有强氧化性,可以氧化N2H4,过量的氨气防止N2H4被氧化;铵盐铵盐是NH4+和酸根离子组成的化合物。铵盐都是晶体,易溶于水。1.物理性质小结铵盐:硫酸铵【(NH4)2SO4,俗称硫铵】氯化铵【NH4Cl,俗称氯铵】硝酸铵【NH4NO3,俗称硝铵、炸药】碳酸氢铵【NH4HCO3,俗称碳铵】铵盐属于铵态氮肥。常用氮肥有铵态氮肥和尿素【CO(NH2)2】氨和铵盐2、铵盐的化学性质1)不稳定性a)非强氧化性酸的铵盐分解产物均为氨气和对应的酸,若酸不稳定,则继续分解为水和对应氧化物。NH4Cl;(NH4)2SO4;(NH4)2CO3;NH4HCO3b)强氧化性酸的铵盐根据温度和加热方式不同,可能发生自身氧化还原性分解(了解)。NH4NO3=N2O↑+2H2O缓慢加热NH4NO3=NH3↑+HNO390~110℃2NH4NO3=2N2↑+O2↑+4H2O500℃NH4Cl中有少量的NaCl,如何提纯?升华吗?氨和铵盐2)与碱反应NH3+H2ONH3·H2ONH4++OH-注意:只有在碱比较浓或者加热条件下,产物才写成氨气,否则写成NH3·H2O。性质延伸:铵根的检验。(加碱、加热、湿润红石蕊)实验室制氨气(发生、收集、干燥、尾气)△Ca(OH)2+2NH4Cl==CaCl2+2NH3↑+2H2ONH4HCO3+NaOH(少量或足量)=氨和铵盐3)水解NH4++H2ONH3·H2O+H+性质延伸:镁条投入氯化铵水溶液中的现象和反应。氯化铵溶液可作除锈剂。氮肥的施用。图2a.加热浓氨水b.向固体氢氧化钠或生石灰中加浓氨水。NH3+H2ONH3·H2ONH4++OH-以上办法可快速获得氨气,但不能称为实验室制法。如何以浓氨水为原料,快速得到氨气?易溶于水的要用防倒吸装置隔离式、肚容式、安全(缓冲)瓶式、蓄液式1.(2008·西安模拟)下图是实验室制取氨气的装置和选用的试剂,其中错误的是AC氨(NH3)的工业制法N2(g)+3H2(g)2NH3(g)△H=-92.4KJ/mol10MPa~30MPa铁触媒4000C~5000C压强:催化剂:温度:①原理②条件选择思考:92.4KJ/mol是指产物的量还是反应物的量?利用氨溶液液化,及时把氨液化分离出来N2ONON2O3NO2(N2O4)N2O5(红为酸酐)氧化物一氧化氮物性:无色有毒、不溶于水的气体化性除硝酸厂尾气不与碱作用生



 三七文档所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。
三七文档所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。
本文标题:高考复习-氮及其化合物
链接地址:https://www.777doc.com/doc-2106705 .html