当前位置:首页 > 中学教育 > 高中教育 > 第二章化学物质及其变化
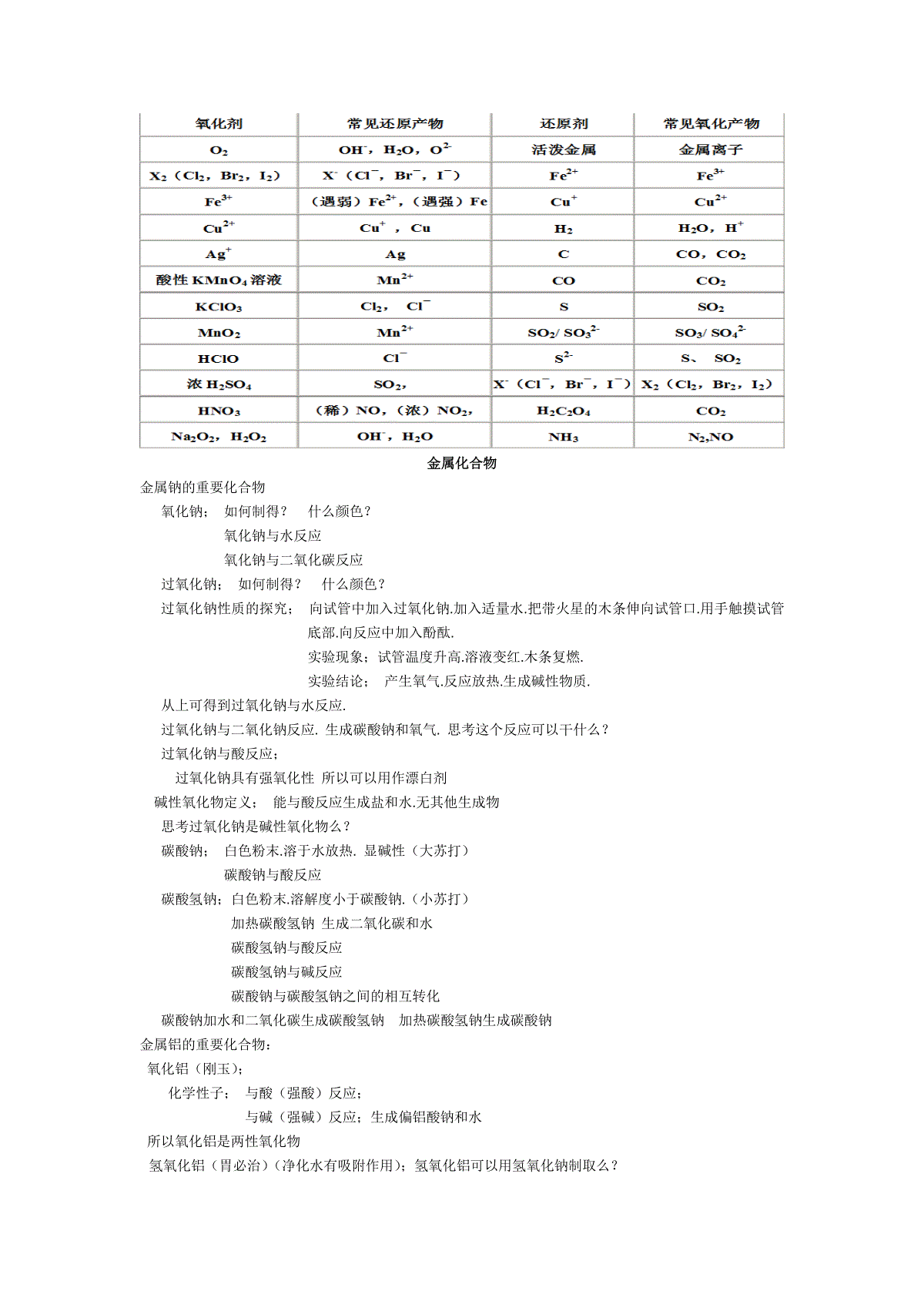
溶液胶体浊液1.溶液:溶质粒子直径小于1NM稳定2.胶体:分散质粒子直径在1-100nm之间在两者之间丁达尔效应电泳3.浊液:分散质粒子直径大于100NM不稳定离子反应:什么叫电解质:在水中或者熔融状态下能导电的化合物.导电能力与溶液中电荷浓度相关电解质的电离:电解质解离成自由移动的离子的过程电离方程式:用化学符号来描述电解质电离的式子离子反应方程式定义:用实际参加反应的离子符号来表示反应的的式子.书写方法:=号两端的可溶于水的化合物拆成离子.气体不拆=号两端有相同的离子可以约去共存:能否发生化学反应能否生成气体沉淀和水氧化还原反应氧化剂:反应中得到电子的是氧化剂氧化剂被还原体现氧化性发生还原反应还原性和氧化性强弱的判断:金属活动性顺序表或者看反应谁氧化性高谁得电子.谁还原性高谁失去电子.氧化性也就是得到电子的能力.还原性也就是失去电子的能力氯化铁和金属铜的反应氧化剂氧化产物还原剂还原产物电子转移的的表示方法:双线桥:双箭号从反应物指向生成物.起止为同一种元素.线上标注得失电子的情况..以及化合价的升降.被氧化或者被还原.单线桥:剪号由还原剂中失去电子的元素指向氧化剂中得电子的元素线上只标出转移电子个数.探究铁及化合物的氧化性还原性1、预测与假设(1)只有氧化性的物质:Fe3+处于最高价态,只有氧化性。(2)只有还原性的物质:Fe处于最低价态,只有还原性。(3)既有氧化性又有还原性的物质:Fe2+处于中间价态,既有氧化性又有还原性。2、实验方案(1)证明Fe3+只有氧化性,需加入还原剂:如铁粉、铜粉等与之反应,以证明其氧化性,加入氯水等氧化性的物质后不反应,说明其无还原性。相关反应的离子方程式为:2Fe3++Fe=3Fe2+、2Fe3++Cu=2Fe2++Cu2+(2)证明Fe只有还原性,需加入氧化剂:如FeCl3溶液、稀酸等与之反应,以证明其还原性。相关反应的离子方程式为:2Fe3++Fe=3Fe2+、Fe+2H+=Fe2++H2↑(3)证明Fe2+有氧化性,需加入还原剂,如锌粉与之反应,以证明其有还原性。加入氧化剂,如氯水、稀硝酸等与之反应,以证明其还原性。相关反应的离子方程式为:Fe2++Zn=Fe+Zn2+、2Fe2++Cl2=2Fe3++2Cl—、3Fe2++NO3—+4H+=3Fe3++NO↑+2H2O常见还原剂与氧化剂金属化合物金属钠的重要化合物氧化钠;如何制得?什么颜色?氧化钠与水反应氧化钠与二氧化碳反应过氧化钠;如何制得?什么颜色?过氧化钠性质的探究;向试管中加入过氧化钠.加入适量水.把带火星的木条伸向试管口.用手触摸试管底部.向反应中加入酚酞.实验现象;试管温度升高.溶液变红.木条复燃.实验结论;产生氧气.反应放热.生成碱性物质.从上可得到过氧化钠与水反应.过氧化钠与二氧化钠反应.生成碳酸钠和氧气.思考这个反应可以干什么?过氧化钠与酸反应;过氧化钠具有强氧化性所以可以用作漂白剂碱性氧化物定义;能与酸反应生成盐和水.无其他生成物思考过氧化钠是碱性氧化物么?碳酸钠;白色粉末.溶于水放热.显碱性(大苏打)碳酸钠与酸反应碳酸氢钠;白色粉末.溶解度小于碳酸钠.(小苏打)加热碳酸氢钠生成二氧化碳和水碳酸氢钠与酸反应碳酸氢钠与碱反应碳酸钠与碳酸氢钠之间的相互转化碳酸钠加水和二氧化碳生成碳酸氢钠加热碳酸氢钠生成碳酸钠金属铝的重要化合物:氧化铝(刚玉);化学性子;与酸(强酸)反应;与碱(强碱)反应;生成偏铝酸钠和水所以氧化铝是两性氧化物氢氧化铝(胃必治)(净化水有吸附作用);氢氧化铝可以用氢氧化钠制取么?氢氧化铝;与酸(强酸)反应与碱反应;生成偏铝酸钠和水注意;!!向氯化铝中加入氢氧化钠的沉淀曲线变化金属铁的重要化合物;氧化物氧化亚铁(有强还原性);黑色粉末氧化铁;红棕色粉末(做涂料)四氧化三铁;黑色粉末(磁性氧化铁)与酸反应生成亚铁和铁离子和水氢氧化物;氢氧化亚铁白色氢氧化铁(有吸附作用可以做净水剂)红褐色氢氧化亚铁与氢氧化铁之间的转化氢氧化亚铁加氧气和水生成氢氧化铁氯化铁加单质铁生成亚铁离子亚铁离子加氯气生成铁离子检验铁离子;加入硫氰化钾溶液变成红色重点!!铝三角氨硝酸硫酸氨气;物理性子;无色有刺激性气味的气体容易溶于水(喷泉实验)氨气的合成;氮气和氢气高温高压催化剂条件下生成氨气..氨气的化学性子;氨气与水反应生成氨水.氨水很不稳定会分解成氨气和水氨气和氯化氢反应生成氯化铵(微小晶体白烟)氨气和氧气在加热和催化剂的条件下生成一氧化氮铵盐的化学性子;受热不稳定性氯化铵加热分解成氨气和氯化氢铵盐和碱反应生成氨气和相应的盐氯化盐和氢氧化钠在加热条件下反应生成氨气和氯化钠和水硫酸;物理性子(纯);无色液体.沸点高.溶解水时释放大量的热(把水烧开)稀释浓硫酸时应该先把浓硫酸慢慢沿着烧杯壁注入到水中.并且不断的搅拌.化学性子;在常温下浓硫酸会与铁和铝反应生成致密氧化膜.(钝化)阻止反应的继续发生.所以可以用铁盆和铝盆盛取浓硫酸浓硫酸的强氧化性.铜和浓硫酸反应在加热的条件下生成硫酸铜的二氧化硫和水碳和浓硫酸反应在加热的条件下生成二氧化碳和二氧化硫和水浓硫酸的三个性子;氢氧化性.吸水性.脱水性硝酸;化学性子;浓硝酸很不稳定.在加热或者光照的条件下生成二氧化氮氧气和水强氧化性;铜和硝酸(稀)反应生成硝酸铜一氧化氮和水铜和硝酸(浓)反应生成硝酸铜和二氧化氮和水(与铁和铝会发生钝化)王水;浓硝酸和浓硫酸的混合物可以溶解黄金硫和氮的氧化物二氧化硫;物理性子;无色有刺激性气味的气体密度比空气大容易液化容易溶于水中化学性子;将二氧化硫溶于水中再向水中加入品红再加入PH试纸观察现象之后加热溶液现象;PH试纸变红品红褪色品红又变红生成有刺激性气味的气体结论;生成酸性物质生成的物质具有漂白性生成的物质会加热分解二氧化硫溶于水变成亚硫酸所以亚硫酸具有漂白性且漂白性不是长久的二氧化硫是酸性氧化物二氧化硫和氢氧化钠反应生成亚硫酸钠和水二氧化硫具有还原性二氧化硫和氧气反应(催化剂)生成三氧化硫三氧化硫;酸性氧化物溶于水生成硫酸三氧化硫和碳酸钙反应生成硫酸钙三氧化硫和氢氧化钙反应生成硫酸钙和水一氧化氮;物理性子;无色不溶于水的有毒气体化学性子;一氧化氮和氧气反应生成二氧化氮二氧化氮;物理性子;红棕红色有刺激性气味的有毒气体密度比空气大容易溶于水化学性子;二氧化氮溶于水中时生成硝酸和一氧化氮(工业制取硝酸)(雷雨发庄稼)氯与非金属的反应.氯气在氢气中点燃(苍白色火焰)氯气与水的反应生成盐酸的次氯酸次氯酸见光分解成氯化氢和氧气氯气溶于水叫做氯水。氯水具有漂白性(思考是那个成分的作用)与碱的反应氯气与氢氧化钠的反应生成氯化钠和次氯酸钠(氯气与水先反应在和氢氧化钠反应)(漂白液)(84)次氯酸根具有氢氧化性氯气和氢氧化钙的反应(漂粉精)氯离子的鉴定;!!加硝酸银再加硝酸1.下列实验基本操作(或实验注意事项)中,主要是出于实验安全考虑的是A.实验剩余的药品不能放回原试剂瓶B.可燃性气体的验纯C.气体实验装置在实验前进行气密性检查D.滴管不能交叉使用2.实验向容量瓶转移液体操作中用玻璃棒,其用玻璃棒的作用是A.搅拌B.引流C.加速反应D.加快热量散失3.标准状况下的1molHe的体积为A.11.2LB.22.4LC.33.6LD.44.8L4.下列关于阿伏加德罗常数的说法正确的是A.阿伏加德罗常数是一个纯数,没有单位B.阿伏加德罗常数就是6.02×1023C.阿伏加德罗常数是指1mol的任何粒子的粒子数D.阿伏加德罗常数的近似值为:6.02×1023mol-15.16g某元素含有6.02×1023个原子,则该元素原子的相对原子质量为A.1B.12C.16D.236.关于2molO2的叙述中,正确的是A.体积为44.8LB.质量为32gC.分子数为6.02×1023D.含有4mol原子7.在1molH2SO4中,正确的是A.含有1molHB.含有6.02×1023个氢原子C.含有6.02×1023个分子D.含有3.01×1023个氧原子8.下列溶液中,溶质的物质的量浓度为0.1mol/L的是A.1L溶液中含有4gNaOHB.1L水中溶解4gNaOHC.0.5L溶液中含有0.2molH2SO4D.9.8gH2SO4溶于1L水配成溶液9.1mol/LH2SO4的含义是()A、1L水中含有1molH2SO4B、1L溶液中含有1molH+C、将98gH2SO4溶于1L水中配成的溶液D、该溶液c(H+)=2mol/L10.下列溶液中,Cl-的物质的量浓度与50mL3mol/LNaCl溶液中Cl-物质的量浓度相等是A.150mL3mol/LKCl溶液B.150mL1mol/LAlCl3溶液C.50mL3mol/LMgCl2溶液D.75mL1.5mol/LMgCl2溶液11.下列溶液中,跟100mL0.5mol/LNaCl溶液所含的Cl-物质的量浓度相同的是()A.100mL0.5mol/LMgCl2溶液B.200mL0.25mol/LCaCl2溶液C.50ml1mol/LNaCl溶液D.25ml0.5mol/LHCl溶液12.配制一定物质的量浓度的NaOH溶液时,造成实验结果偏低的是()A.定容时观察液面仰视B.定容时观察液面俯视C.有少量NaOH溶液残留在烧杯中D.容量瓶中原来有少量蒸馏水13.8g无水硫酸铜配成0.1mol/L的水溶液,下列说法正确的是()A.溶于500mL水中B.溶于1L水中C.溶解后溶液的总体积为500mLD.溶解后溶液的总体积为1L14、0.5L1mol/LFeCl3溶液与0.2L1mol/LKCl溶液中n(Cl—)之比为()A、1﹕1B、3﹕1C、15﹕2D、5﹕215、在1L溶有0.1molNaCl和0.1molMgCl2的溶液中,c(Cl—)为()A、0.05mol/LB、0.1mol/LC、0.2mol/LD、0.3mol/L11.下列说法正确的是A.摩尔是七个基本单位之一,符号为molB.1mol任何物质都含有6.02×1023个分子C.标准状况下,任何气体的摩尔体积为22.4L/molD.摩尔质量在数值上等于该物质的相对分子质量或相对相对原子质量13.下列叙述正确的是A.相同条件下,相同体积的气体,其气体分子物质的量也相等B.相同条件下,等物质的量的甲烷和一氧化碳所含的分子数一定相等C.相同条件下,若物质的量相同的物质,则它们所含的体积也相同D.相同条件下的一氧化碳气体和氮气,若体积相等,则质量也相等14.下列实验操作中叙述正确的是A.萃取操作实验试经常用的仪器是:分液漏斗B.分液时,分液漏斗下层液体从下口放出,上层液体从上口倒出C.容量瓶用蒸馏水洗涤后不烘干就使用D.为了便于操作,浓溶液稀释或固体溶解可直接在容量瓶中进行15.下列说法正确的是(NA表示阿伏加德罗常数的值)A.1molH2中含有的电子数为2NAB.标准状态下,1mol水所含的氧原子数为1NAC.常温常压下,28g氮气所含的原子数为2NAD.2g氢气所含的氢原子数为NA16.下列溶液中,Cl-的物质的量浓度与50mL1mol/LAlCl3溶液中Cl-物质的量浓度相等是A.150mL3mol/LKCl溶液B.75mL1.5mol/LMgCl2溶液C.50mL1mol/LNaCl溶液D.50mL2mol/LAlCl3溶液简要计算题:(1)0.2molH2O中,含有氢原子的物质的量为多少?它有多少个分子?(2)0.5molH2SO4含有多少摩尔氧原子?含有多少g硫原子?若完全电离,可电离出多少个H+?1.下列物质属于电解质的是A.CuB.N2C.KNO3D.乙醇2.下列生产、生活中的事例不属于...氧化还原反应的是A.金属冶炼B.石灰水粉刷墙壁C.食物腐败D.燃放鞭炮3.现榨的苹果汁在空气中会由淡绿色变为棕黄色,其原因可能是()。A.苹果汁中的Fe2+变成Fe3+B.苹果汁含有Cu2+ZXYC.苹果汁含有OH−D.苹果汁含有Na+5.下列反应的离子方程式不.正确的是A.锌与硫酸铜溶液反应:Zn+Cu2+=Zn2++CuB.氢氧化钠与盐酸反应:OH-+H+=H2OC.铁与




 三七文档所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。
三七文档所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。
本文标题:第二章化学物质及其变化
链接地址:https://www.777doc.com/doc-2186178 .html