当前位置:首页 > 医学/心理学 > 药学 > FDA对药物杂质的控制要求.
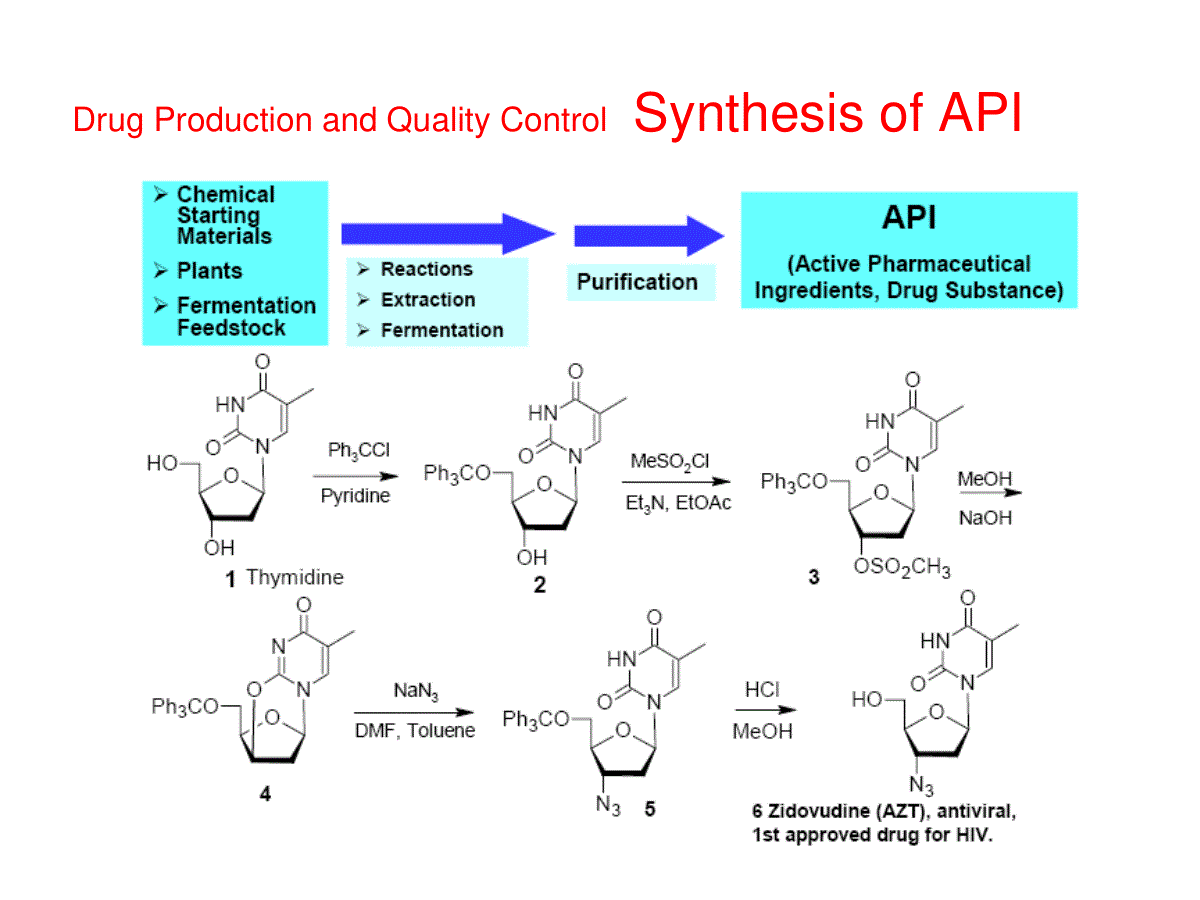
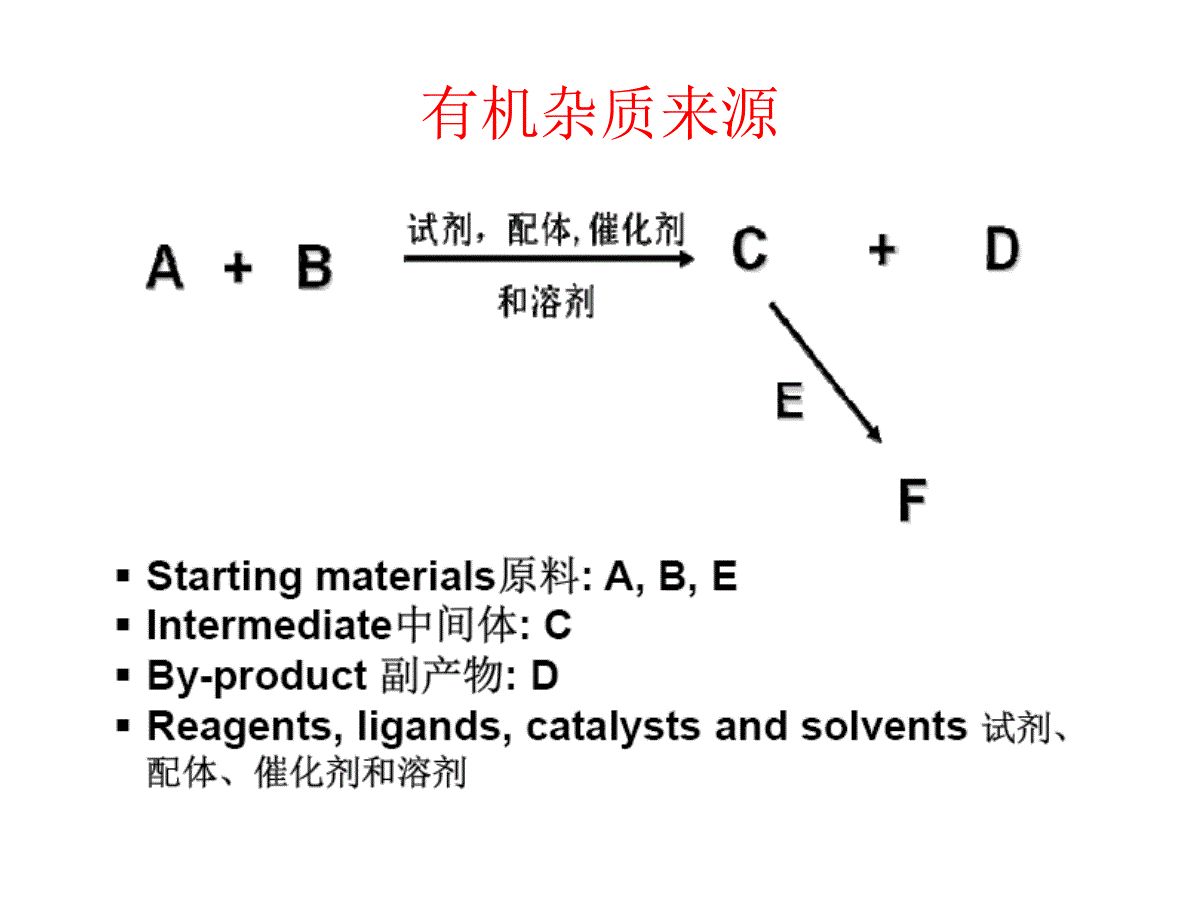
FDA对药物杂质的控制要求Dr.GeorgeMa马小波博士Toronto,CANADA多伦多市,加拿大国家食品药品监督管理局培训中心高级培训班“美国仿制药申报最新要求和案例分析”FDA对药物杂质的控制要求:Contents目录•原料药与成品药中的有机杂质•有机杂质来源和控制•有机杂质控制限度的论证•案例分析:杂质控制限度的设置和论证•练习-杂质控制限度的设置和论证•原料药与成品药中的残留溶剂•残留溶剂的指导原则和控制限额的建立•案例分析:如何建立残留溶剂控制限额•具有基因毒性杂质的控制•练习-残留溶剂控制限额的建立和论证DrugProductionandQualityControlSynthesisofAPIFDA对药物杂质的控制要求原料药与成品药中的有机杂质1999年11月,FDA-“仿制药申请的原料药杂质研究指导原则”,“仿制药申请的制剂杂质研究指导原则”。2003年,ICH修订的Q3A(R)“新原料药杂质研究指导原则”,“新制剂的杂质研究指导原则”(简称Q3B(R))。杂质分类–有机杂质合成杂质(SyntheticImpurity)或工艺杂质(ProcessImpurity):一般来自生产过程中残留的原料、中间体、试剂、配体和催化剂以及反应副产物。只与原料药的生产过程有关,在原料药和制剂的储存中一般不可能增长。通过对合成路线的分析可以确定某一杂质是否为合成杂质。降解产物(DegradationProduct):来源于原料药通过各种不同的化学反应途径的降解,一般需要结合对合成路线的分析和试验研究的结果,以确定某一杂质是否为降解产物。有的有机杂质既是合成杂质,又是降解产物。–无机杂质:来自生产过程所用的试剂(如氯化物)、配体和催化剂(如钯,铂等),包括重金属或其它金属残留,以及无机盐(例如,助滤剂、活性炭等)。它们通常是已知和确定的。–残留溶剂:生产过程中使用后未完全除去的溶剂(如甲醇、甲苯、四氢呋喃等),残留的可挥发性试剂(如三乙胺等)和反应中生成的可挥发产物。有机杂质来源常见的降解反应常见的降解反应确定降解产物-强制降解研究(ForcedDegradationStudy)StressType强制降解类型CommonStress常用强制降解CommonForcedDegradationConditions常见强制降解条件SolutionStress溶液降解Acid酸0.1NHCl,室温-100℃,4小时Base碱0.1NNaOH,室温-100℃,4小时H2O2双氧水1-3%H2O2,室温,4小时Heat加热H2O,100℃,4小时UV&VisuableLight紫外光和可见光(300-800nm)15小时(相当于波长范围为300-800nm,约2.0百万勒克斯时Stress固态降解Thermal加热60℃,14天Heat/humidity加热/湿度40℃/75%RH,14天UV&VisuableLight紫外光和可见光(300-800nm)15小时(相当于波长范围为300-800nm,约2.0百万勒克斯时强制降解试验:将原料药或制剂置于比通常储存条件剧烈得多的试验条件下进行稳定性考察的一系列试验。目的:了解该药品的稳定性及其降解途径与降解产物。在一定程度上对有关物质分析方法的专属性进行验证。实际操作:试剂的浓度、反应的温度和时间等都应根据具体情况作调整。强制降解程度:根据经验一般认为,控制适当的强制降解条件,从而达到大约10%的原料药降解是比较合适的。常见的强制降解具体试验项目与试验条件确定降解产物-原料药和制剂的稳定性试验•长期(25℃±2℃、相对湿度60%±5%、至少12个月)稳定性试验•加速(40℃±2℃、相对湿度75%±5%、至少6个月)稳定性试验•分析研究收集到的稳定性测试数据(StabilityData)也是确定降解产物的重要依据之一。一般测定不同时间样品的HPLC图谱并进行比较分析,并与长期保留制剂样品的测定结果进行比较。•在强制降解试验研究过程中注意观察样品外观性状、原料药含量等变化,并与杂质检查结果相互印证。•原料药和杂质的分离和检测:将可能的中间体和副产物作为杂质进行柱效、流动相及流动相比例、波长和分离度等方法学的研究。•待方法建立成熟后,根据中间体和副产物的安全性和获得杂质标样的难易程度,决定是否定为已知杂质。•如果杂质标样难以得到,且比较安全,可考虑采用杂质校正因子加上相对保留时间的方法,或采用杂质相对保留时间加上自身对照的方法,对该杂质进行定量分析。•如果得不到该杂质样品作为标样,对于有紫外吸收的样品可以用二极管阵列检测器,考察未精制的粗品,并对比已精制过的样品,确定粗品种各成分的分离度和样品中可能杂质的检测波长。方法确立后,可采用自身对照方法或面积归一化法控制杂质。原料药与成品药中的有机杂质药品中有机杂质的分类–有机杂质特定杂质(SpecifiedImpurities):特定杂质是指在质量标准中分别规定了明确的限度,并单独进行控制的杂质。特定杂质包括化学结构已知的杂质(SpecifiedIdentifiedImpurity)和化学结构未知(SpecifiedUnidentifiedImpurity)的杂质。美国药典通常采用代号来指认特定杂质,如相关化合物A(RelatedCompoundA)等。非特定杂质(UnspecifiedImpurities):在标准中未单独列出,而仅采用一个通用的限度进行控制的一系列杂质。其结构未知,在药品中出现的种类与几率并不固定。一般采用合适的定性分析指标加以指认,如相对保留时间为3.5的杂质。–有机杂质检测确定原料药和制剂中潜在的合成杂质和降解产物,需要应用专业的有机化学知识对有关合成化学反应和条件、原料药化学结构、理化性质、稳定性等进行全面的科学分析和论证,并且比较实验室对样品的常规分析和强制降解(ForcedDegradationStudy),以及稳定性研究的结果。Impurities:Origination&IdentificationClassificationofimpurities•SyntheticImpurities(Residualsubstancesinthesynthesis)StartingmaterialBy-productsIntermediatesDegradationduringsynthesisReagents,ligandsandcatalysts•DegradationProducts•Hydrolysis•Oxidation•Esterification•Eliminationofwater,HCl,etc.•Dehydrogenation•ResidualSolvents/OVI’sSolvents/reagentsusedinthereactions,purificationprocessorformedduringreactionMeOH,EtOH,IPA,THF,Dichloromethane,Acetone,Triethylamine,etc.ImpurityResources-API&DrugProductManufacturingProcessesImpurities:Origination&IdentificationListsofImpuritiesinICHOrganicimpurities•Eachidentifiedspecifiedimpurity•Eachunidentifiedspecifiedimpurity•Anyunspecifiedimpuritywithanacceptancecriterionofnotmorethan(≤)thefigureintheidentificationthresholdinAttachment1,ICHQ3A(R)•TotalimpuritiesResidualsolventsInorganicimpurities有机杂质控制限度设置•美国药典杂质:在美国药典正文(monograph)中列为特定杂质(SpecifiedImpurities)的杂质,其控制限度应设置不高于美国药典的限度。•非美国药典杂质:如果美国药典正文没有对该杂质设置控制限度,或者美国药典没有改药物的正文,则根据ICH的杂质指导原则Q3A(R)和Q3B(R),同时也参考其它药典,如欧洲药典(EP)和英国药典(BP)来设置该杂质的控制限度。就ICH的杂质指导原则来说,如果该杂质在实验测试中的实际观测水平高于ICH的鉴定限,则必须确定为特定杂质,其控制限度必须设置为不高于ICH的论证限(QualificationThreshold)。•非特定杂质:在药品中出现的种类与几率并不固定。因此,在药品的临床前与临床研究中,很难对这些杂质的安全性进行评估。为将这些杂质可能带来的安全性隐患降至最小,ICH的杂质指导原则Q3A(R)和Q3B(R)对其限度用鉴定限(IdentificationThreshold)做了明确的规定,要求在原料药标准中任何单个非特定杂质的限度不得超过鉴定限。在仿制药或改剂型药品以及药品上市后变更原料药生产商等研究中,即使出现了新的杂质,只要新杂质的含量低于表中的鉴定限,就可以认定这些新杂质的安全性。有机杂质控制限度设置•FindouttheMaximumDailyDose(MMD,每日最大剂量)fromPDR,CPS,etc.•UseMDDtocalculatetheICHThresholds•ReportingThreshold(RT)•IdentificationThreshold(IT)•QualificationThreshold(QT)每日最大剂量1报告限(ReportingThreshold)2,3鉴定限(IdentificationThreshold)3论证限(QualificationThreshold)3≤2g/day0.05%每日摄入量0.10%或1.0毫克(取低值)每日摄入量0.15%或1.0毫克(取低值)≥2g/day0.03%0.05%0.05%1每日原料药的服用量。2更高的报告限必须提供充足的理由。3如果杂质的毒性特别高则适合于更低的报告限。ControlofImpurities:Compendia&ICHEstablishingAcceptanceCriteriaforImpurities•Acceptancecriteria(limits)forimpuritiesshouldbesetnohigherthanthelevelthathasbeenqualified.•Inestablishingimpuritylimits,thefirstcriticalconsiderationiswhetheranimpurityisspecifiedintheUSP.•IfthereisamonographintheUSPthatincludesalimitforanidentifiedspecifiedimpurity,thelimitsshouldbesetnohigherthantheofficialcompendiallimit.•IfqualifiedbyanFDA-approvedhumandrugproduct,thelimitsmustbeconsistentwiththelevelobservedintheapprovedhumandrugproduct.•Inothercircumstances(e.g.metabolites),thelimitsmayneedtobesettighterthanthequalifiedleveltoassuredrugsubstancequality.IftheleveloftheimpurityisabovethelevelspecifiedintheUSP,qualificationisnecessary.Then,ifappropriate



 三七文档所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。
三七文档所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。
本文标题:FDA对药物杂质的控制要求.
链接地址:https://www.777doc.com/doc-2871542 .html