当前位置:首页 > 行业资料 > 其它行业文档 > 有机化学 第十七章 杂环化合物
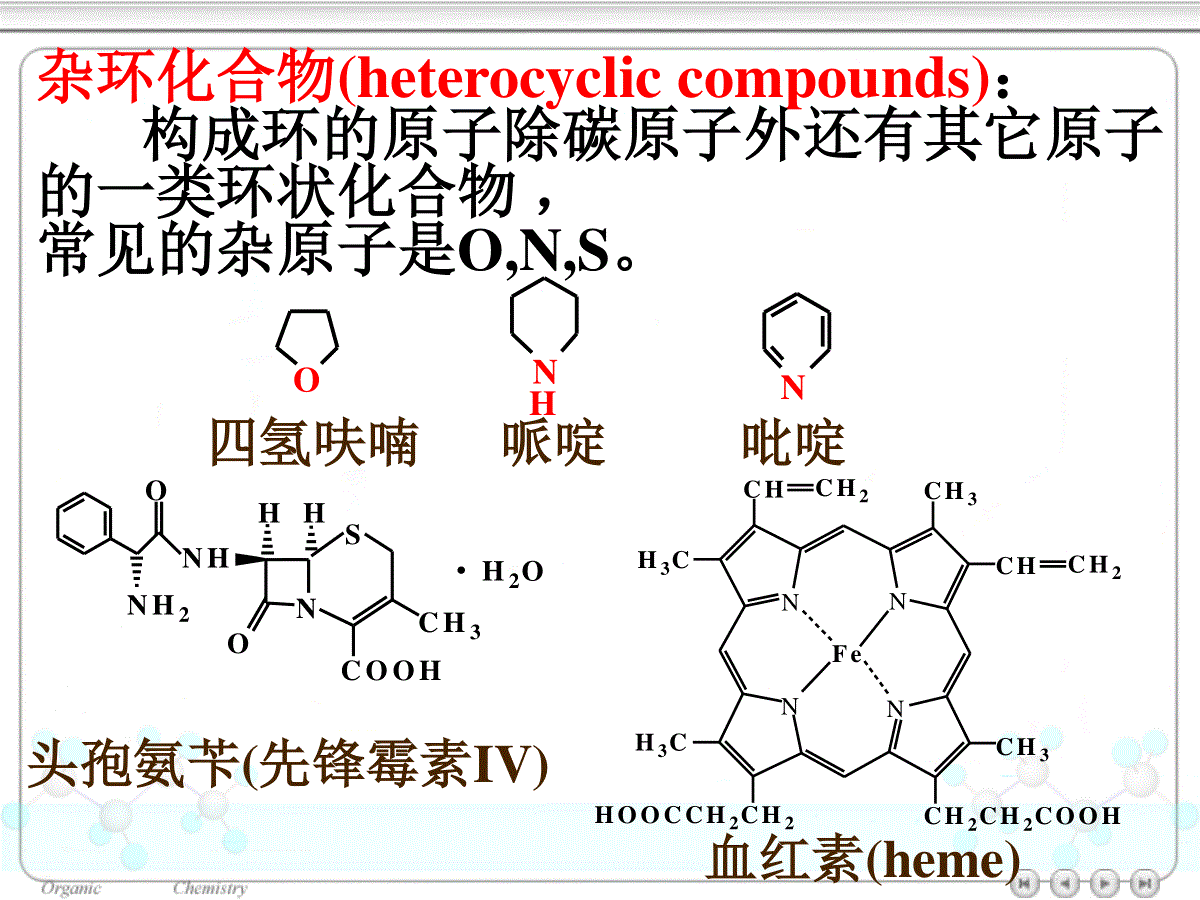
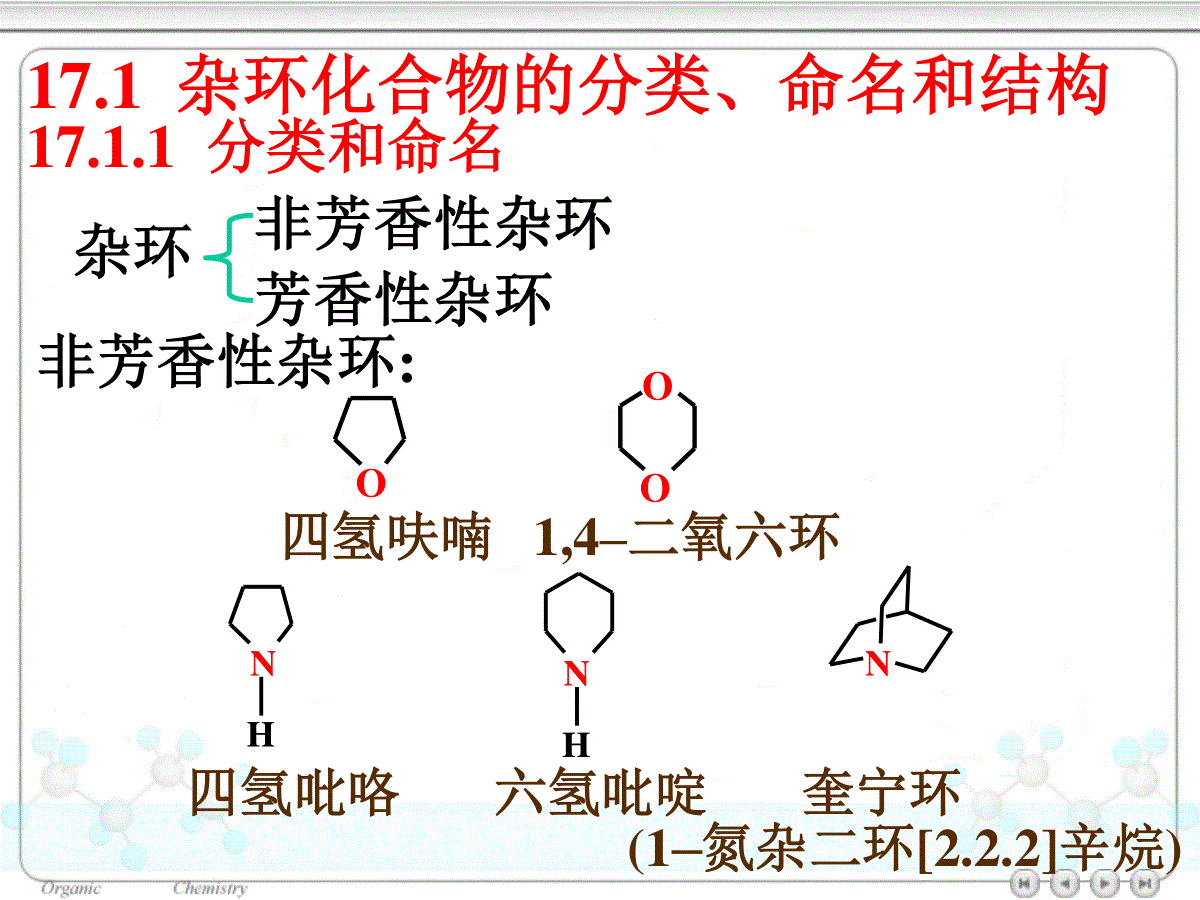
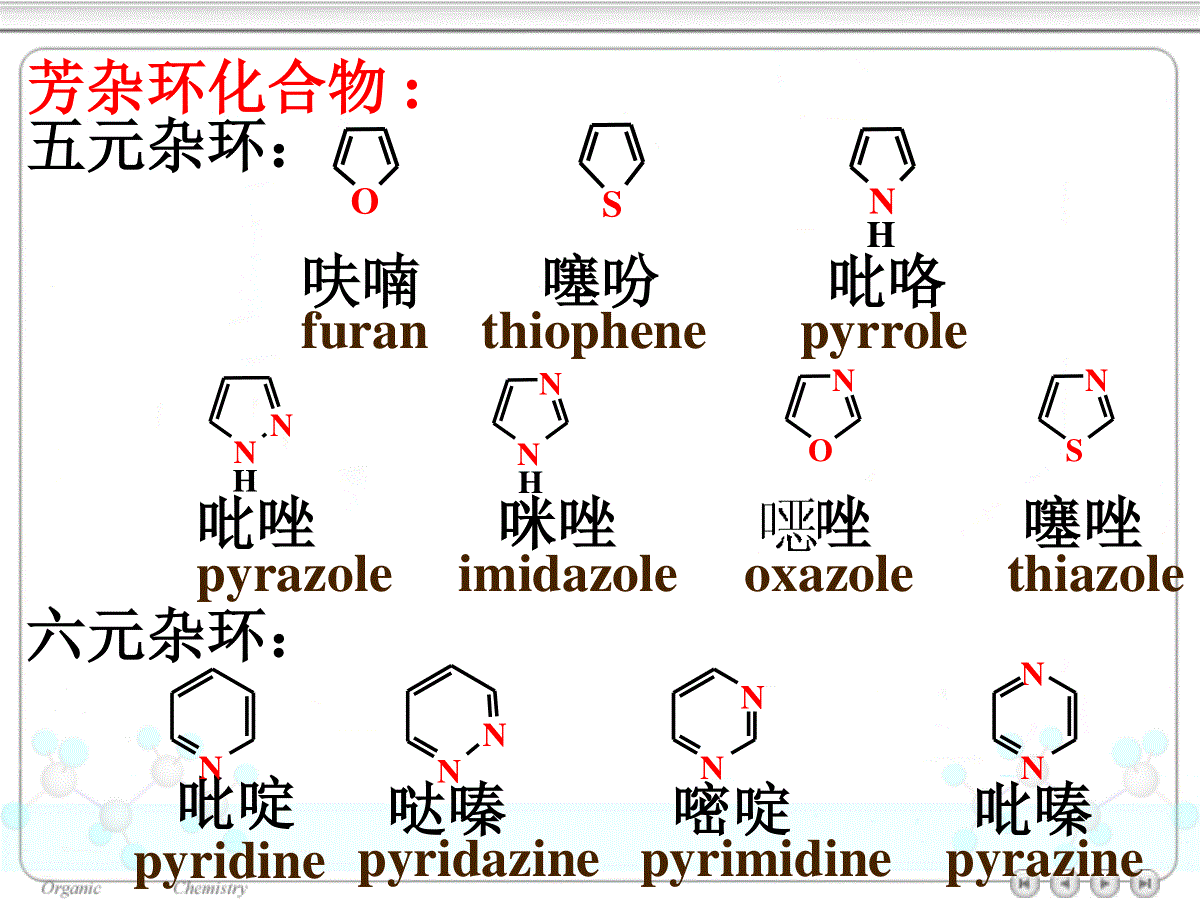
第十七章杂环化合物17.1杂环化合物的分类、命名和结构17.1.1分类和命名17.1.2结构和芳香性17.2五元杂环化合物17.2.1五元杂环化合物的化学性质(1)硝化(2)磺化(3)卤化(4)Friedel-Crafts酰基化17.2.2常见的五元杂环化合物17.3六元杂环化合物17.3.1吡啶和嘧啶(1)硝化(2)磺化(3)卤化17.3.2喹啉和异喹啉17.3.3嘌呤杂环化合物(heterocycliccompounds):构成环的原子除碳原子外还有其它原子的一类环状化合物,常见的杂原子是O,N,S。ONH2NHNHHOSCOOHCH3·H2O头孢氨苄(先锋霉素IV)NNNNFeCHCH2H3CCH3CHCH2H3CHOOCCH2CH2CH2CH2COOHCH3血红素(heme)四氢呋喃哌啶吡啶ONNH17.1杂环化合物的分类、命名和结构17.1.1分类和命名杂环非芳香性杂环芳香性杂环非芳香性杂环:四氢吡咯六氢吡啶奎宁环OOO四氢呋喃1,4–二氧六环NNNHH(1–氮杂二环[2.2.2]辛烷)芳杂环化合物:五元杂环:呋喃噻吩吡咯furanthiophenepyrroleOSNH吡唑咪唑唑噻唑pyrazoleimidazoleoxazolethiazoleNNNNONSNHH六元杂环:吡啶pyridine哒嗪嘧啶吡嗪pyridazinepyrimidinepyrazineNNNNNNNOSNH苯并呋喃苯并噻吩吲哚(苯并吡咯)benzofuranthionaphtheneindole稠杂环:苯并咪唑苯并唑苯并噻唑嘌呤benzomidazolebenzoxazolebenzothiazolepurineNNHONSNNNNNHNNN喹啉异喹啉吖啶quinolineisoquinolineacridine•杂环的编号一般从杂原子开始,含多个杂原子时按O、S、N的次序编号。O12345SNCH312345ON1234567CH3CO5–甲基噻唑6–甲氧基苯并唑•对于含一个杂原子的杂环也可把靠近杂原子的位置叫做α位,其次为β和γ位。Nαβγα'β'17.1.2结构和芳香性呋喃、噻吩和吡咯:C、N原子均为sp2杂化,环上的5个原子处于同一平面;5个p轨道都垂直于环所在的平面且相互平行;p轨道的相互交盖形成闭合的共轭体系,体系中有6个π电子。NHHHHHsp2–杂化参与大π键生成的p轨道中的电子图17.1吡咯的轨道结构NH呋喃、吡咯和噻吩的芳香性:•共振能分别为67、88和117kJ/mol。•容易发生亲电取代反应•键长趋于平均化表17.1呋喃、噻吩、吡咯及环戊二烯的键长/nmX-C1(单键)C2-C3C3-C4呋喃0.1362(0.143)0.13610.1430噻吩0.1714(0.182)0.13700.1423吡咯0.1370(0.147)0.13820.1417环戊二烯0.15020.13410.1455XX=O,S,NH,CH2CCCC键长/nm0.1540.134NHHHHHN图17.2吡啶的轨道结构NNNNNN0.134nm0.139nm0.140nmC–N:0.147nmC=N:0.128nm•核磁共振信号大都出现在较低场Oδ6.24δ7.29Sδ7.18δ6.99NHδ6.68δ6.22δ6.28δ6.43吡啶是典型的芳香杂环化合物芳香性:苯噻吩吡咯呋喃NNH偶极矩/C·m:7.5×10–306.1×10–3017.2五元杂环化合物17.2.1五元杂环化合物的化学性质呋喃、吡咯的遇酸或氧化剂容易开环或聚合。它们在亲电取代反应中,使用温和的试剂:(1)硝化一般采用硝酸乙酰脂CH3COONO2作硝化剂S+CH3COONO2Ac2O–AcOH-0℃SNO2+SNO22–硝基噻吩(66%)3–硝基噻吩(10%)XX=NH,O,S杂原子的+C效应,增加了杂环的亲电取代反应的活性。亲电取代反应活性顺序:NOSHS+H2SO4(浓)室温SSO3H噻吩-2-磺酸(~75%)煤焦油中提取的苯含0.5%噻吩。这是制取无噻吩苯的一种方法(3)卤化采用溶剂稀释、低温(2)磺化吡咯、呋喃通常采用吡啶与SO3的加合物:N+SO3N·SO3N+N·SO3100℃NSO3·NHClNSO3H吡咯-2-磺酸吡啶盐(90%)HHHO+Br2OO0℃OBrα–溴代呋喃(90%)S+Br2室温SBrα–溴代噻吩AcOH(4)Friedel–Crafts酰基化催化剂:SnCl4,BF3等O+(CH3CO)2OO2–乙酰基呋喃(75%~92%)BF3COCH3+(CH3CO)2O2–乙酰基吡咯(60%)150~200℃COCH3NHNH呋喃、噻吩、吡咯的制备Paal–Knorr合成法γ–二羰基化合物酸催化下脱水或与氨或硫化物作用吡咯、呋喃、噻吩亲电取代反应的区域选择性:反应主要发生在2位上杂环上有两种不同位置的取代:亲电试剂进攻2位的中间体稳定X进攻3位进攻2位E+XEHXEHXEHXEHXEHX=O,S,NHZnO–Cr2O3–MnO2O(C5H8O4)nH+,H2OCHO(CHOH)3CH2OH-3H2OOCHOHCl/△聚戊糖戊糖糠醛OOCH3H3CTsOH甲苯,△OH3CCH3P2S5170℃NH3甲苯,△SH3CCH3NH3CCH3H17.2.2常见的五元杂环化合物17.3六元杂环化合物17.3.1吡啶和嘧啶NNH烟碱(尼古丁)颠茄碱(阿托品)麻黄碱咖啡碱NCH3CH3NHCH3HOHHC6H5NNOH3CONNCH3CH3生物碱一般是指从动植物中得来的、具有碱性的、有强烈生理作用的一类有机含氮化合物:吡啶的碱性:NNH2NH不稳定的极限结构亲电取代反应:类似硝基苯,一般需在强烈条件下才能发生亲电取代反应。NδδδδNE+进攻α位进攻β位NEHNEHNEHNEHNEHNEH亲电试剂主要进入β位(1)硝化NHNO3,KNO3H2SO4,Fe,300℃NNO23–硝基吡啶(22%)(2)磺化230℃NH2SO4,HgSO4N3–吡啶磺酸(70%)SO3H(3)卤化300℃NBr2/浮石NBr3–溴吡啶(39%)+NBrBr3,5–二溴吡啶芳环上的亲核取代反应:吡啶更容易发生亲核取代反应,反应的部位是在环上的α位和4位:CH3OH/NN2–甲氧基吡啶(95%)ClNaOCH3△OCH3NNNaNH2△NHNaNH3H2ONα-氨基吡啶NH2NC6H5Li△NC6H5α-苯基吡啶+LiH环上氮原子的性质:亲核性:吡啶能与卤代烷作用生成相当于季铵盐的产物吡啶盐:NCH3INCH3I300℃NCH3+NCH3α–甲基吡啶γ–甲基吡啶碱性:N+HClNHClN+SO3N·SO3还原:N+H2NHNi180℃六氢吡啶(哌啶)有机碱催化剂、环氧树脂的固化剂氧化:吡啶与过氧化氢作用生成吡啶–N–氧化物:NH2O2,AcOH65℃NOHNO3,H2SO490℃NONO2PCl3,CHCl3NNO2△吡啶–N–氧化物(95%)4–硝基吡啶–N–氧化物(90%)4–硝基吡啶(80%)含有吡啶环的药物分子:NCOOHNCONH2烟酸烟酰胺(维生素pp)NCON(C2H5)烟酰二乙胺(可拉明)NCONHNH2NCH2OHHOH3CCH2OH异烟酰肼(雷米封)维生素B617.3.2喹啉和异喹啉17.3.3嘌呤


 三七文档所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。
三七文档所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。
本文标题:有机化学 第十七章 杂环化合物
链接地址:https://www.777doc.com/doc-3149798 .html