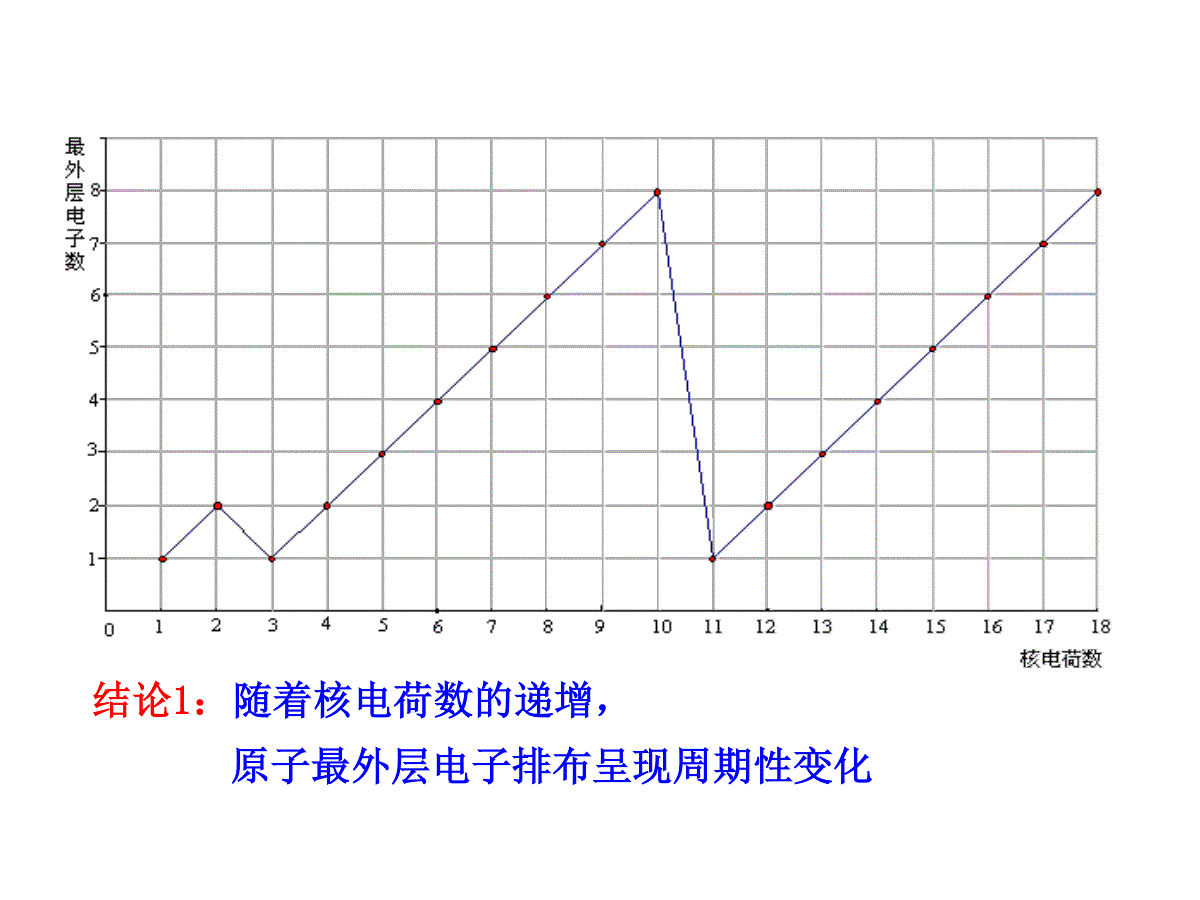
第2课时元素周期律1.学会通过数据观察和分析归纳出一般事物规律的方法以及掌握元素周期律的相关内容。2.懂得如何应用元素周期律的知识判断元素微粒之间大小的比较。3.进一步学习元素周期律的实质,体会结构决定性质这一化学特征。《镓的故事》1875年法国化学家布瓦博德朗发现了镓,并把测得的关于镓的主要性质公布了。不久收到了俄国化学家门捷列夫的来信,指出镓的比重不应该是4.7,而是5.9~6.0……第二年他重新测定,结果镓的比重确实为5.94。门捷列夫预言的依据是什么呢?交流与讨论1:观察1~18号元素的原子结构示意图可以发现原子最外层电子排布随核电荷数的递增有什么规律性的变化?结论1:随着核电荷数的递增,原子最外层电子排布呈现周期性变化交流与讨论2:观察下表:用横坐标表示元素原子核外最外层电子数,以纵坐标表示原子半径,根据数据表作图,表示出3~9、11~17号元素的原子最外层电子数与原子半径的函数图像。3~9号元素Li(锂)Be(铍)B(硼)C(碳)N(氮)O(氧)F(氟)Ne(氖)原子半径/pm1521118877706664—11~17号元素Na(钠)Mg(镁)Al(铝)Si(硅)P(磷)S(硫)Cl(氯)Ar(氩)原子半径/pm18616014311711010499—提示:1.稀有气体元素原子半径的测定依据与其他元素不同,没有可比性。2.表中数据的单位是pm(皮米),1pm=10-12m。结论2:随着核电荷数的递增,元素原子半径呈周期性变化,每隔一定数目,元素原子半径重复由大到小的变化趋势(稀有气体元素除外)。原子半径大小的比较方法:从左到右,逐渐减小;从上到下,逐渐增大。(补充)微粒半径比较(除稀有气体)比较微粒半径大小的依据(三看)一看电子层数:电子层数越多半径越大NaNa+原子半径相应的阴离子半径原子半径相应的阳离子半径(稀有气体元素除外)Cl-Cl;Fe2+Fe3+O2-F-Na+Mg2+电子层数相同,核电荷数越大半径越小。二看核电荷数:三看核外电子数:电子层和核电荷数都相同时,核外电子数越多,半径越大。交流与讨论3:观察3~9、11~17号元素的最高正化合价与最低负化合价。3~9号元素LiBeBCNOFNe最高正价最低负价+1—+2—+3—+5-3—-2—-10NaMgAlSiPSClAr最高正价最低负价+1—+2—+3—+4-4+5-3+6-2+7-10结论3:随着核电荷数的递增,元素的主要化合价呈周期性变化,元素的最高正价重复出现由+1到+7递增,最低负价由-4到-1递增的变化。(稀有气体元素除外)+4-411~17号元素元素的主要化合价的变化规律4、同周期元素化合价:+1→+7;-4→-1(稀有气体元素为零)2、元素的最高正价=最外层电子数元素的最低负价=最外层电子数-8O无最高正价,F无正价3、最低负价与最高正价的关系为:最高正价+︱最低负价︳=81、金属元素无负价;金属性元素原子失电子的能力非金属性元素原子得电子的能力注意:想一想:元素的金属性、非金属性是否也呈现周期性变化?判断依据是什么呢?金属性(非金属性)的强弱只与原子失(得)电子的能力大小有关,与失(得)电子的多少无关。①比较金属与水(酸)置换出H2的难易;②比较最高价氧化物的水化物的碱性强弱;③能否从化合物中置换出另一种金属。a.比较与氢气生成气态氢化物的难易和稳定性;b.比较最高价氧化物的水化物的酸性强弱;c.能否从化合物中置换出另一种非金属单质。如何设计实验证明三者金属性强弱?NaMgAlSiPSCl如何设计实验证明四者非金属性强弱?原子序数111213元素符号NaMgAl单质与水(或酸)反应情况氢氧化物碱性强弱冷水剧烈热水较快盐酸剧烈盐酸较快NaOHMg(OH)2Al(OH)3金属性NaMgAl强碱中强碱两性实验探究一:Na、Mg、Al的金属性递变探究:原子序数14151617元素符号SiPSCl单质与H2化合的难易气态氢化物的稳定性最高价氧化物对应水化物的酸性H2SiO3极弱酸H3PO4中强酸H2SO4强酸HClO4最强酸高温光照或点燃爆炸化合磷蒸气加热非金属性SiPSCl很不稳定SiH4不稳定PH3不很稳定H2S稳定HCl实验探究二:Si、P、S、Cl的非金属性结论:同一周期的元素随着原子序数的递增,金属性逐渐减弱,非金属性逐渐增强根据上述知识可以总结如下:元素周期律:元素的性质(原子的最外层电子数、原子半径、元素的主要化合价、元素的金属性和非金属性等)随着元素核电荷数的递增而呈现周期性的变化。元素周期律的实质:元素周期律是元素原子的核外电子排布的周期性变化的必然结果。随着核电荷数的递增元素周期律决定了归纳出最外层电子数1→8(K层电子数1→2)核外电子排布呈周期性变化引起了化合价:+1→+7-4→-1(稀有气体元素为零)元素性质呈周期性变化原子半径大→小(稀有气体元素除外)元素金属性与非金属性元素的性质随原子序数的递增呈周期性的变化1.原子序数为1~18的元素,随着核电荷数的递增不呈周期性变化的是()A.原子量B.主要化合价C.原子半径D.电子层数AD2.下列各组元素递变情况错误的是()A.Li、Be、B原子最外层电子数依次增多B.P、S、Cl元素最高正化合价依次升高C.B、C、N、O、F原子半径依次增大D.Li、Na、K、Rb的金属性依次增强C3.下列元素的原子半径依次减小的是()A.Na、Mg、AlB.N、O、FC.P、Si、AlD.C、Si、NaAB4.下列各组原子序数所表示的两种元素,能形成AB2型离子化合物的是:()A.6和8B.11和16C.12和17D.8和16BC5.下列有关元素周期律的叙述,正确的是()A.元素周期律的本质是元素原子核外电子排布呈周期性变化B.元素周期律的本质是原子半径呈周期性变化C.元素周期律的本质是元素的性质随原子序数的递增呈周期性变化D.元素周期律的本质是元素的性质随原子量的递增而呈周期性变化A




 三七文档所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。
三七文档所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。
本文标题:12--13学年最新版高中化学同步授课课件:专题1 第一单元 第2课时 元素周期律(苏教版必修2)
链接地址:https://www.777doc.com/doc-3721967 .html