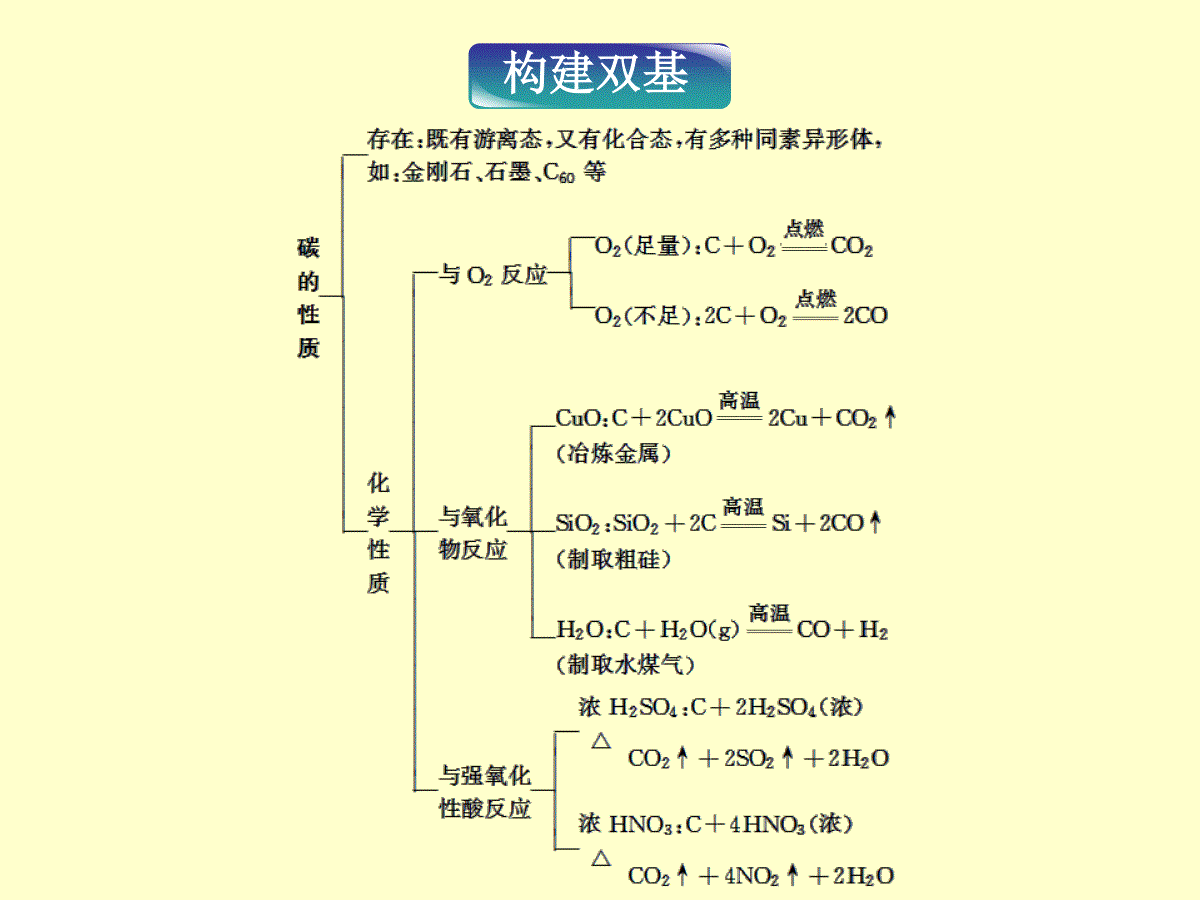
第四章非金属及其化合物第一节无机非金属材料的主角——硅[考纲展示]1.了解碳、硅元素单质及其重要化合物的主要性质及应用。2.了解碳、硅元素单质及其重要化合物对环境质量的影响。判断下列说法的正误:1.(2011·高考山东卷10TB)单质硅常用作半导体材料和光导纤维。()2.(2011·高考江苏卷3TB)二氧化硅不与任何酸反应,可用石英制造耐酸容器。()3.(2009·高考江苏卷4TB)水玻璃可用于生产黏合剂和防火剂。()体验高考××√构建双基深灰黑色CO2+Na2CO3+H2O===2NaHCO3↓SiO2+2NaOH===Na2SiO3+H2OSiO2+Na2CO3=====高温Na2SiO3+CO2↑2C+SiO2=====高温Si+2CO↑光导纤维思考感悟有人认为SiO2既能与酸反应又能与碱反应,所以认为它是一种两性氧化物,你同意这种看法吗?【提示】不同意。因为SiO2只与酸中的氢氟酸反应,而与其他酸都不反应,SiO2是一种酸性氧化物。K2O·Al2O3·6SiO2考点1硅及其化合物的特性物质一般规律硅及其化合物的特性Si硅的还原性大于碳非金属单质与强碱溶液反应一般不产生H2硅可与强碱溶液反应产生H2非金属一般不与非氧化性酸反应一般非金属单质为绝缘体硅为半导体,常用于电子部件2C+SiO2=====高温Si+2CO↑Si+4HF===SiF4↑+2H2↑物质一般规律硅及其化合物的特性SiO2酸性氧化物一般与水反应生成相应的酸SiO2不溶于水,不与水反应酸性氧化物一般不与酸发生复分解反应“较强酸制较弱酸”是复分解反应的一个规律,H2CO3酸性大于H2SiO3但以下反应不符合此规律:H2SiO3无机酸一般易溶于水硅酸和原硅酸均难溶于水硅酸盐大多数硅酸盐难溶于水常见的可溶性硅酸盐为Na2SiO3,水溶液俗称水玻璃、泡花碱SiO2+4HF===SiF4↑+2H2ONa2CO3+SiO2=====高温Na2SiO3+CO2↑CaCO3+SiO2=====高温CaSiO3+CO2↑特别提醒:(1)不要混淆硅和二氧化硅的用途,用作半导体材料的是晶体硅而不是SiO2,用于制作光导纤维的是SiO2而不是硅。(2)不要混淆常见含硅物质的成分,①计算机芯片的成分是晶体硅而不是SiO2。②水晶、石英、玛瑙等主要成分是SiO2,而不是硅酸盐。③传统无机非金属材料陶瓷、水泥、玻璃的主要成分是硅酸盐。即时应用1.根据下图所示A、B、D、E的变化关系,回答下列问题:(1)写出A、D的名称:A:________,D:________。(2)写出B→A的化学方程式:________________________________________。(3)写出下列反应的离子方程式:A→E:_________________________________;B→E:_____________________________。解析:由图示分析:A与O2反应生成B,而B与碳在高温下反应生成A,可推知A是单质,B是氧化物。而A、B均能与NaOH溶液反应,应确认A是硅,B是二氧化硅,则E是硅酸钠,D是硅酸。答案:(1)硅硅酸(2)SiO2+2C高温,Si+2CO↑(3)Si+2OH-+H2O===SiO2-3+2H2↑SiO2+2OH-===SiO2-3+H2O2.如图所示物质的转化关系中,A是一种固体单质,E是一种白色沉淀。请回答下列问题:(1)B的化学式是_______,目前B已被用作______的主要原料。(2)B和a溶液反应的离子方程式是____________________________________________________。(3)C和过量的盐酸反应的离子方程式是____________________________________________________。解析:C与过量的盐酸反应生成白色沉淀E,则E可能是硅酸或氯化银,若E是氯化银,则C是硝酸银,A为银,则根据已有知识,银可以与硝酸反应生成硝酸银,而银与硝酸反应能生成三种产物,不符合框图中物质间的转化关系。则E只能为硅酸,则C为硅酸盐,A为硅,a溶液为强碱的水溶液,进一步推出B为二氧化硅。答案:(1)SiO2光导纤维(2)SiO2+2OH-===SiO2-3+H2O(3)SiO2-3+2H+===H2SiO3↓考点2二氧化碳的性质及CO2-3、HCO-3的检验1.CO2与常见溶液的反应和现象(1)Ca(OH)2或Ba(OH)2溶液CO2不足时,生成白色沉淀;CO2过量时,先生成白色沉淀,后沉淀消失,溶液变澄清。(2)Na2SiO3溶液CO2不足:Na2SiO3+H2O+CO2===Na2CO3+H2SiO3↓;CO2过量:Na2SiO3+2H2O+2CO2===2NaHCO3+H2SiO3↓。两种情况均生成白色胶状沉淀。(3)饱和Na2CO3溶液Na2CO3+CO2+H2O===2NaHCO3↓,有白色固体析出。2.CO2-3、HCO-3的检验检验二者的基本方法是将其转化为CO2气体,再用澄清石灰水变浑浊来检验CO2。如果被检物中已知没有碳酸氢盐、亚硫酸盐和亚硫酸氢盐的干扰时,可用直接加盐酸的方法检验碳酸盐。若存在其他干扰时,则需要用以下方法来检验。离子CO2-3HCO-3原理CO2-3+Ca2+===CaCO3↓CaCO3+2H+===Ca2++H2O+CO2↑HCO-3+H+===CO2↑+H2O方法向少量待检验溶液中滴加足量的CaCl2或BaCl2溶液,有白色沉淀生成,再加入适量的酸,白色沉淀溶解且生成使澄清石灰水变浑浊的无色无味的气体,则待检溶液中有CO2-3向少量待检验溶液中滴加足量的CaCl2或BaCl2溶液,无明显现象,再向溶液中加入足量的酸,若溶液中有使澄清石灰水变浑浊的无色无味的气体生成,则待检验溶液中有HCO-3特别提醒:(1)CO2通入CaCl2或BaCl2溶液不会产生白色沉淀,因为碳酸的酸性弱于盐酸,CO2与CaCl2或BaCl2溶液不发生反应。(2)检验CO2-3、HCO-3时不能用Ba(OH)2或Ca(OH)2溶液来代替可溶性钡盐或可溶性钙盐溶液,原因是OH-能将HCO-3转化为CO2-3。即时应用3.(2013·辽宁五校高三期末联考)用4种溶液进行实验,下表中“操作及现象”与“溶液”对应关系错误的是()选项操作及现象溶液A通入CO2,溶液不变浑浊,先通入CO2再通入氨气,溶液变浑浊CaCl2溶液B通入CO2,溶液变浑浊,继续通CO2至过量,浑浊消失Na2SiO3溶液C通入CO2,溶液变浑浊,再加入品红溶液,红色褪去Ca(ClO)2溶液D通入CO2,溶液变浑浊,继续通CO2至过量,浑浊消失,再加入足量NaOH溶液,又变浑浊Ca(OH)2溶液解析:选B。在CaCl2溶液中通入CO2气体,因溶液中H2CO3电离产生的CO2-3浓度很小,故不能生成CaCO3沉淀,若再通入NH3,则NH3+H+===NH+4,促进了H2CO3的电离,溶液中CO2-3浓度增大,与Ca2+结合生成CaCO3沉淀,A正确;在Na2SiO3溶液中通入CO2产生H2SiO3而变浑浊,继续通入CO2,浑浊不消失,B错误;在Ca(ClO)2溶液中通入CO2,能生成CaCO3和HClO,滴加品红溶液,HClO有漂白作用而使其褪色,C正确;在Ca(OH)2溶液中通入CO2,先生成CaCO3而变浑浊,然后生成Ca(HCO3)2浑浊消失,加入OH-,HCO-3+OH-===CO2-3+H2O,CO2-3+Ca2+===CaCO3↓,D正确。4.(2013·泰州高三第一次模拟)将足量CO2气体通入水玻璃(Na2SiO3溶液)中,然后加热蒸干,再在高温下充分灼烧,最后得到的固体物质是()A.Na2SiO3B.Na2CO3、Na2SiO3C.Na2CO3、SiO2D.SiO2解析:选A。将足量CO2气体通入水玻璃中,发生反应:2CO2+Na2SiO3+2H2O===H2SiO3↓+2NaHCO3;加热蒸干高温灼烧时发生反应:H2SiO3=====△H2O+SiO2,2NaHCO3=====△Na2CO3+CO2↑+H2O;SiO2+Na2CO3=====高温Na2SiO3+CO2↑,各反应物存在如下关系,H2SiO3~2NaHCO3,H2SiO3~SiO2,2NaHCO3~Na2CO3~SiO2,由上述关系可知,最后所得固体物质是Na2SiO3,故选A项。学科规律方法提升数轴法突破有关CO2与碱反应的计算及图像题CO2通入NaOH、Ca(OH)2等强碱溶液的反应与CO2气体的通入量有关,当CO2通入少量时生成碳酸盐,当CO2通入过量时生成碳酸氢盐;当CO2的通入量介于两者之间时,既有正盐又有酸式盐生成,因此推断时一定要注意CO2与碱之间量的关系。以CO2与NaOH溶液反应为例:CO2+2NaOH===Na2CO3+H2OCO2+NaOH===NaHCO3当n(OH-)∶n(CO2)的值不同时产物如下:例1将足量的CO2不断通入KOH、Ba(OH)2、KAlO2的混合溶液中,生成沉淀的物质的量与通入CO2的体积的关系可表示为()关键字句审读明确解题思路1.注意CO2的用量:“足量的CO2”。2.弄清CO2与各离子间反应的先后顺序。3.看清横纵坐标分别代表CO2的体积和生成沉淀的物质的量。4.错误展示:D5.误区警示:(1)分清CO2与各离子(或物质)反应的顺序是做好本题的关键。(2)注意反应后哪些物质是沉淀,哪些反应不生成沉淀,看清图像的变化趋势。【解析】将CO2通入KOH、Ba(OH)2、KAlO2的混合溶液中,依次发生如下反应:①Ba(OH)2+CO2===BaCO3↓+H2O②2KOH+CO2===K2CO3+H2O③2KAlO2+3H2O+CO2===2Al(OH)3↓+K2CO3④K2CO3+CO2+H2O===2KHCO3⑤BaCO3+H2O+CO2===Ba(HCO3)2根据沉淀生成和溶解的情况对照图像可知C正确。【答案】C【解题感悟】反应顺序的判断当有多种组分与一种物质反应时,判断反应顺序的方法是:先假设与其中的一种组分反应,若产物还能与另一种组分反应,则假设错误。如将CO2通入KOH、Ba(OH)2混合溶液中,假设CO2先与KOH反应,则生成的K2CO3会与Ba(OH)2继续反应生成BaCO3,故假设错误,应该是CO2先与Ba(OH)2反应。(2013·长沙高三质检)向四只盛有一定量NaOH溶液的烧杯中通入不同量的CO2气体后,在所得溶液中逐滴加入稀盐酸至过量,并将溶液加热,产生的CO2气体与HCl物质的量的关系如图(忽略CO2的溶解和HCl的挥发):例2则下列分析都正确的组合是()溶液组成主要成分对应图像溶液中离子浓度关系ANa2CO3、NaHCO3Ⅰc(Na+)=c(HCO-3)BNaHCO3、Na2CO3Ⅱc(CO2-3)=c(HCO-3)CNaOH、Na2CO3Ⅲc(OH-)>c(CO2-3)DNa2CO3Ⅳc(Na+)=c(CO2-3)+c(HCO-3)+c(H2CO3)解析】向NaOH溶液中通入CO2时,所得溶液中的溶质可能有:①只有Na2CO3,②只有NaHCO3,③Na2CO3与NaHCO3,④Na2CO3与NaOH。而NaOH、Na2CO3、NaHCO3分别与HCl反应的方程式为:NaOH+HCl===NaCl+H2O;Na2CO3+HCl===NaHCO3+NaCl和NaHCO3+HCl===NaCl+CO2↑+H2O;设未产生气体时消耗盐酸的体积为V1,产生CO2气体时消耗盐酸的体积为V2,由图Ⅰ可知,开始就有CO2生成,故溶质应为NaHCO3,c(Na+)=c(HCO-3),A错;由图Ⅱ知,开始无CO2生成,且V2=2V1,可知溶质为Na2CO3和NaHCO3,且c(CO2-3)=c(HCO-3),B正确;由图Ⅲ可知,V1=V2,所以溶质为Na2CO3,C错;由图Ⅳ知,V1=2V2,溶质为NaOH、Na2CO3,且c(OH-)=c(CO2-3),D错。【




 三七文档所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。
三七文档所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。
本文标题:2014届高三化学一轮复习双基课件:第4章第1节 无机非金属材料的主角――硅(人教版)
链接地址:https://www.777doc.com/doc-3737742 .html