当前位置:首页 > 中学教育 > 高中教育 > 河南省洛阳市第一高级中学2019-2020学年高二化学12月月考试题
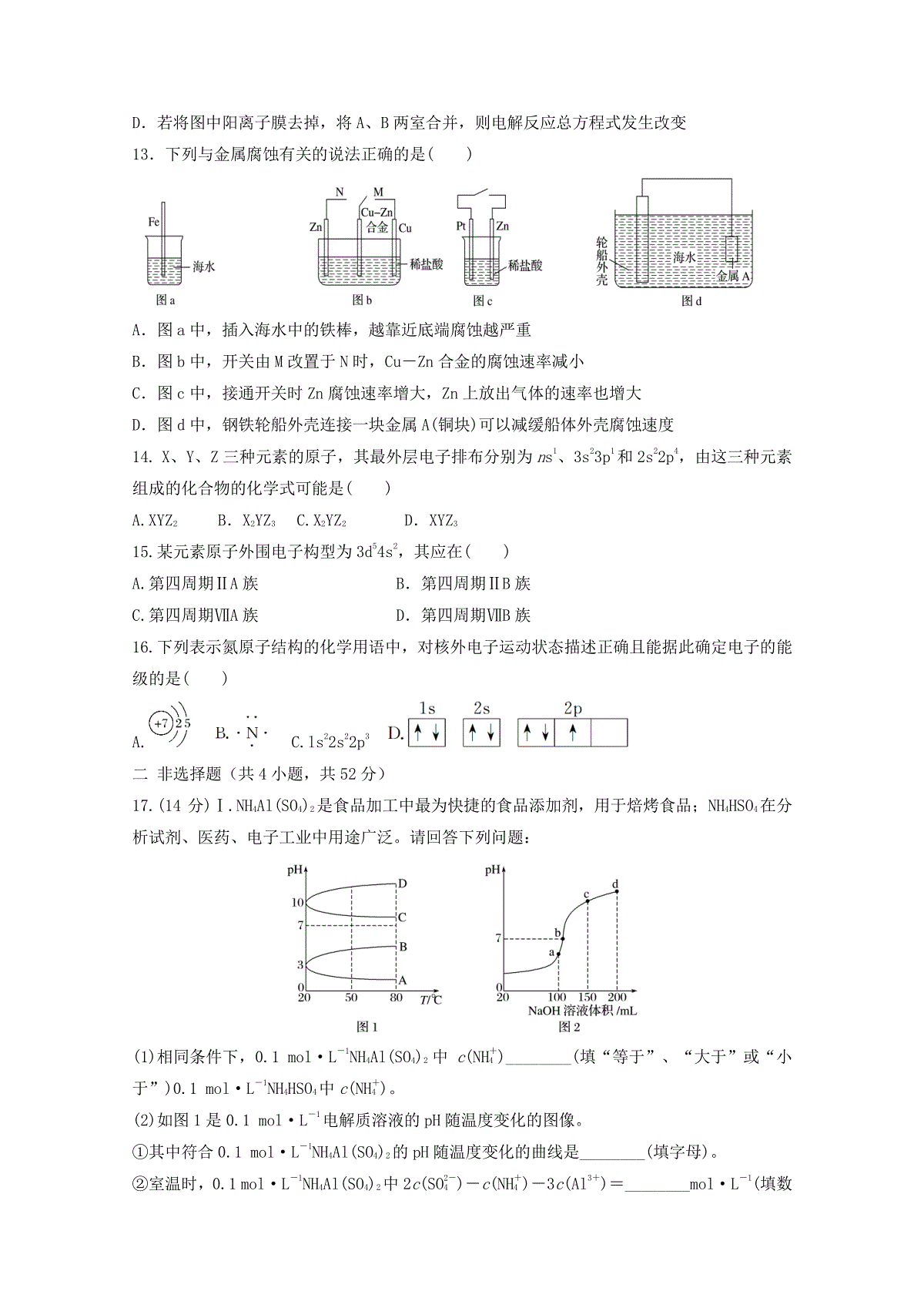
河南省洛阳市第一高级中学2019-2020学年高二化学12月月考试题可能用到的相对原子质量:H:1C:12N:14O:16Na:23Cl:35.5S:32Fe:56Cu:64Zn:65Ag:108Pb:207一、选择题(每小题3分,共48分。每小题只有1个正确答案)1.化学与社会、生活密切相关,对下列现象或事实的解释正确的是()选项现象或事实解释A用热的烧碱溶液洗去油污Na2CO3可直接与油污反应B漂白粉在空气中久置变质漂白粉中的CaCl2与空气中的CO2反应生成CaCO3C施肥时,草木灰(有效成分为K2CO3)不能与NH4Cl混合使用K2CO3与NH4Cl混合,生成氨气会降低肥效DFeCl3溶液可用于铜质印刷线路板制作FeCl3能从含Cu2+的溶液中置换出铜2.室温下,将一元酸HA的溶液和KOH溶液等体积混合(忽略体积变化),实验数据如下表:下列判断正确的是()A.实验①反应后的溶液中:c(A﹣)>c(K+)>c(OH﹣)>c(H+)B.实验①反应后的溶液中:c(OH﹣)=c(K+)﹣c(A﹣)=mol/LC.实验②反应后的溶液中:c(A﹣)+c(HA)<0.1mol/LD.实验②反应后的溶液中:c(K+)+c(OH﹣)=c(H+)+c(A﹣)3.25℃时在10mL0.1mol•L﹣1Na2CO3溶液中逐滴加入0.1mol•L﹣1HCl溶液20mL,溶液中部分含碳微粒的物质的量随溶液pH的变化如图所示.下列说法不正确的是()A.HCl溶液滴加一半时,溶液pH>7B.当溶液的pH=8时,溶液中NaHCO3的物质的量浓度为0.1mol•L﹣1C.0.1mol•L﹣1Na2CO3溶液:c(Na+)+c(H+)=c(OH﹣)+2c(CO32﹣)+c(HCO3﹣)D.在M点:c(Na+)>c(CO32﹣)=c(HCO3﹣)>c(OH﹣)>c(H+)4.已知:pOH=﹣lgc(OH﹣),298K时,向20.00mL0.10mol•L﹣1氨水中滴入0.10mol•L﹣1实验编号起始浓度/(mol·L-1)反应后溶液的pHc(HA)c(KOH)①0.10.19②x0.27的盐酸,溶液的pH和pOH与加入盐酸体积关系如图所示.下列说法正确的是()A.曲线PJN表示溶液中pH的变化B.M点水的电离程度比J点大C.M、P两点的数值之和a+b=14D.pH与pOH交叉点J对应的V(盐酸)=20.00mL5.下列溶液中各微粒的浓度关系正确的是()A.pH相等的①NH4Cl②(NH4)2SO4③NH4HSO4溶液:c(NH4+)大小顺序为①>②>③B.0.lmol·L-1CuSO4·(NH4)2SO4·6H2O溶液:c(SO42-)c(NH4+)c(Cu2+)c(OH-)c(H+)C.0.1mol·L-1Na2CO3溶液:C(Na+)+c(H+)=c(HCO3-)+c(CO32-)+c(OH-)D.等体积、等物质的量浓度的CH3COONa和CH3COOH混合后的溶液:c(CH3COO-)+2c(OH-)=2c(H+)+c(CH3COOH)6.H2C2O4为二元弱酸。20℃时,配制一组c(H2C2O4)+c(HC2O4-)+c(C2O42-)=0.100mol·L-1的H2C2O4和NaOH混合溶液,溶液中部分微粒的物质的量浓度随pH的变化曲线如右图所示。下列指定溶液中微粒的物质的量浓度关系一定正确的是()A.pH=2.5的溶液中:c(H2C2O4)+c(C2O42-)c(HC2O4-)B.c(Na+)=0.100mol·L-1的溶液中:c(H+)+c(H2C2O4)=c(OH-)+c(C2O42-)C.c(HC2O4-)=c(C2O42-)的溶液中:c(Na+)0.100mol·L-1+c(HC2O4-)D.pH=7.0的溶液中:c(Na+)=2c(C2O42-)7.常温下,将CO2通入2LpH=12的KOH溶液中。溶液中水电离出的OH-的浓度(φ)与通入的CO2的体积(V)的关系如图所示。下列叙述不正确的是()A.a点溶液中,水电离出的c(H+)=1×10-12mol·L-1B.b点溶液中:c(H+)=1×10-7mol·L-1C.c点溶液中:c(K+)=2[c(CO2-3)+c(HCO-3)+c(H2CO3)]D.d点溶液中:c(K+)=2c(CO2-3)+c(HCO-3)8.20mL0.1mol/L溶液中含有Fe2+,向其中滴加NaOH溶液至pH=4,溶液中有沉淀生成,过滤,得沉淀和滤液.已知:Ksp=[Fe(OH)3]=4.0×10﹣38,Ksp=[Fe(OH)2]=8.0×10﹣16.下列叙述不正确的是()A.沉淀中只有Fe(OH)3B.滤液c(Fe3+)=4.0×10﹣8mol/LC.沉淀中有Fe(OH)3和Fe(OH)2D.向滤液中滴加FeCl2溶液,无沉淀产生9.已知锌及其化合物的性质与铝及其化合物相似。如图横坐标为溶液的pH,纵坐标为Zn2+或[Zn(OH)4]2-的物质的量浓度的对数。下列说法中错误的是()A.在该温度下,Zn(OH)2的溶度积(Ksp)为1×10-17B.往1.0L1.0mol·L-1ZnCl2溶液中加入NaOH固体至pH=6,没有Zn(OH)2沉淀生成C.往ZnCl2溶液中加入足量的氢氧化钠溶液,反应的离子方程式为Zn2++4OH-===[Zn(OH)4]2-D.某废液中含Zn2+,为提取Zn2+可以控制溶液中pH的范围为8.0~12.010.甲醇燃料电池容易携带、容易存储等优点,目前被认为将会替代传统的电池成为携带型设备的主要电源。如图是甲醇的质子交换膜型燃料电池模型,下列有关说法正确的是()A.Y极为电池的负极B.X极的电极反应式:CH3OH+H2O-6e-===CO2+6H+C.若常温下用该电池电解100mLKCl溶液至pH=12时,电池质子交换膜迁移的A为0.01molD.空气以20%为氧气计算,X极每消耗1mol甲醇,Y极必消耗168L空气中的氧气11.以熔融Li2CO3和K2CO3为电解质,天然气经重整催化作用提供反应气的燃料电池如下图。下列说法正确的是()A.以此电池为电源电解精炼铜,当有0.1mole-转移时,有3.2g铜溶解B.若以甲烷为燃料气时负极反应式:CH4+5O2--8e-===CO2-3+2H2OC.该电池使用过程中需补充Li2CO3和K2CO3D.空气极发生的电极反应式为O2+4e-+2CO2===2CO2-312.工业上用电解法处理含镍酸性废水并得到单质Ni的原理如图所示。下列说法不正确的是()已知:①Ni2+在弱酸性溶液中发生水解②氧化性:Ni2+(高浓度)>H+>Ni2+(低浓度)A.碳棒上发生的电极反应:4OH--4e-===O2↑+2H2OB.电解过程中,B室中NaCl溶液的物质的量浓度将不断减小C.为了提高Ni的产率,电解过程中需要控制废水pHD.若将图中阳离子膜去掉,将A、B两室合并,则电解反应总方程式发生改变13.下列与金属腐蚀有关的说法正确的是()A.图a中,插入海水中的铁棒,越靠近底端腐蚀越严重B.图b中,开关由M改置于N时,Cu-Zn合金的腐蚀速率减小C.图c中,接通开关时Zn腐蚀速率增大,Zn上放出气体的速率也增大D.图d中,钢铁轮船外壳连接一块金属A(铜块)可以减缓船体外壳腐蚀速度14.X、Y、Z三种元素的原子,其最外层电子排布分别为ns1、3s23p1和2s22p4,由这三种元素组成的化合物的化学式可能是()A.XYZ2B.X2YZ3C.X2YZ2D.XYZ315.某元素原子外围电子构型为3d54s2,其应在()A.第四周期ⅡA族B.第四周期ⅡB族C.第四周期ⅦA族D.第四周期ⅦB族16.下列表示氮原子结构的化学用语中,对核外电子运动状态描述正确且能据此确定电子的能级的是()A.C.ls22s22p3二非选择题(共4小题,共52分)17.(14分)Ⅰ.NH4Al(SO4)2是食品加工中最为快捷的食品添加剂,用于焙烤食品;NH4HSO4在分析试剂、医药、电子工业中用途广泛。请回答下列问题:(1)相同条件下,0.1mol·L-1NH4Al(SO4)2中c(NH+4)________(填“等于”、“大于”或“小于”)0.1mol·L-1NH4HSO4中c(NH+4)。(2)如图1是0.1mol·L-1电解质溶液的pH随温度变化的图像。①其中符合0.1mol·L-1NH4Al(SO4)2的pH随温度变化的曲线是________(填字母)。②室温时,0.1mol·L-1NH4Al(SO4)2中2c(SO2-4)-c(NH+4)-3c(Al3+)=________mol·L-1(填数值表达式)。(3)室温时,向100mL0.1mol·L-1NH4HSO4溶液中滴加0.1mol·L-1NaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图2所示。试分析图中a、b、c、d四个点,水的电离程度最大的是____________;在b点,溶液中各离子浓度由大到小的排列顺序是________________________________。Ⅱ.pC是指极稀溶液中溶质物质的量浓度的常用对数负值,类似pH。如某溶液溶质的浓度为1×10-3mol·L-1,则该溶液中该溶质的pC=-lg10-3=3。已知H2CO3溶液中存在下列平衡:CO2+H2OH2CO3、H2CO3H++HCO-3、HCO-3H++CO2-3图3为H2CO3、HCO-3、CO2-3在加入强酸或强碱溶液后,达到平衡时溶液中三种成分的pCpH图。请回答下列问题:(1)在pH=9时,H2CO3溶液中浓度最大的含碳元素的离子为______。(2)pH4时,溶液中H2CO3的pC总是约等于3的原因是____________________。18.(12分)第三代混合动力车,可以用电动机、内燃机或二者结合推动车辆汽车上坡或加速时,电动机提供推动力,降低汽油的消耗;在刹车或下坡时,电池处于充电状态。(1)混合动力车的内燃机以汽油为燃料,汽油(以辛烷C8H18计)和氧气充分反应,生成1mol水蒸气放热569.1kJ。则该反应的热化学方程式为_______________________________________________________________。(2)混合动力车目前一般使用镍氢电池,该电池中镍的化合物为正极,储氢金属(以M表示)为负极,碱液(主要为KOH)为电解质溶液。镍氢电池充放电原理示意如图,其总反应式为H2+2NiOOH2Ni(OH)2。根据所给信息判断,混合动力车上坡或加速时,乙电极周围溶液的pH________(填“增大”、“减小”或“不变”),该电极的电极反应式为___________________________________。(3)Cu2O是一种半导体材料,可通过如图所示的电解装置制取,电解总反应式为2Cu+H2O=====通电Cu2O+H2↑,阴极的电极反应式是_______________________________________________________________。用镍氢电池作为电源进行电解,当电池中有1molH2被消耗时,Cu2O的理论产量为________g。(4)远洋轮船的钢铁船体在海水中易发生电化学腐蚀。为防止这种腐蚀,通常把船体与浸在海水里的Zn块相连,或与像铅酸蓄电池这样的直流电源的________(填“正”或“负”)极相连。19.(12分)食盐中的抗结剂是亚铁氰化钾,其化学式为K4[Fe(CN)6]·3H2O。试回答下列问题:(1)查阅资料知:虽然亚铁氰化钾自身毒性很低,但其水溶液与酸反应放出极毒的氰化氢(HCN)气体;亚铁氰化钾加热至一定温度时能分解产生氰化钾(KCN)。据此判断,烹饪食品时应注意的问题为______________________________________________________。(2)在25℃时,将amol·L-1的KCN溶液与0.01mol·L-1的盐酸等体积混合,反应达到平衡时




 三七文档所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。
三七文档所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。
本文标题:河南省洛阳市第一高级中学2019-2020学年高二化学12月月考试题
链接地址:https://www.777doc.com/doc-8360010 .html