当前位置:首页 > 中学教育 > 高中教育 > 四川省三台中学实验学校2019-2020学年高一化学上学期期末适应性考试试题
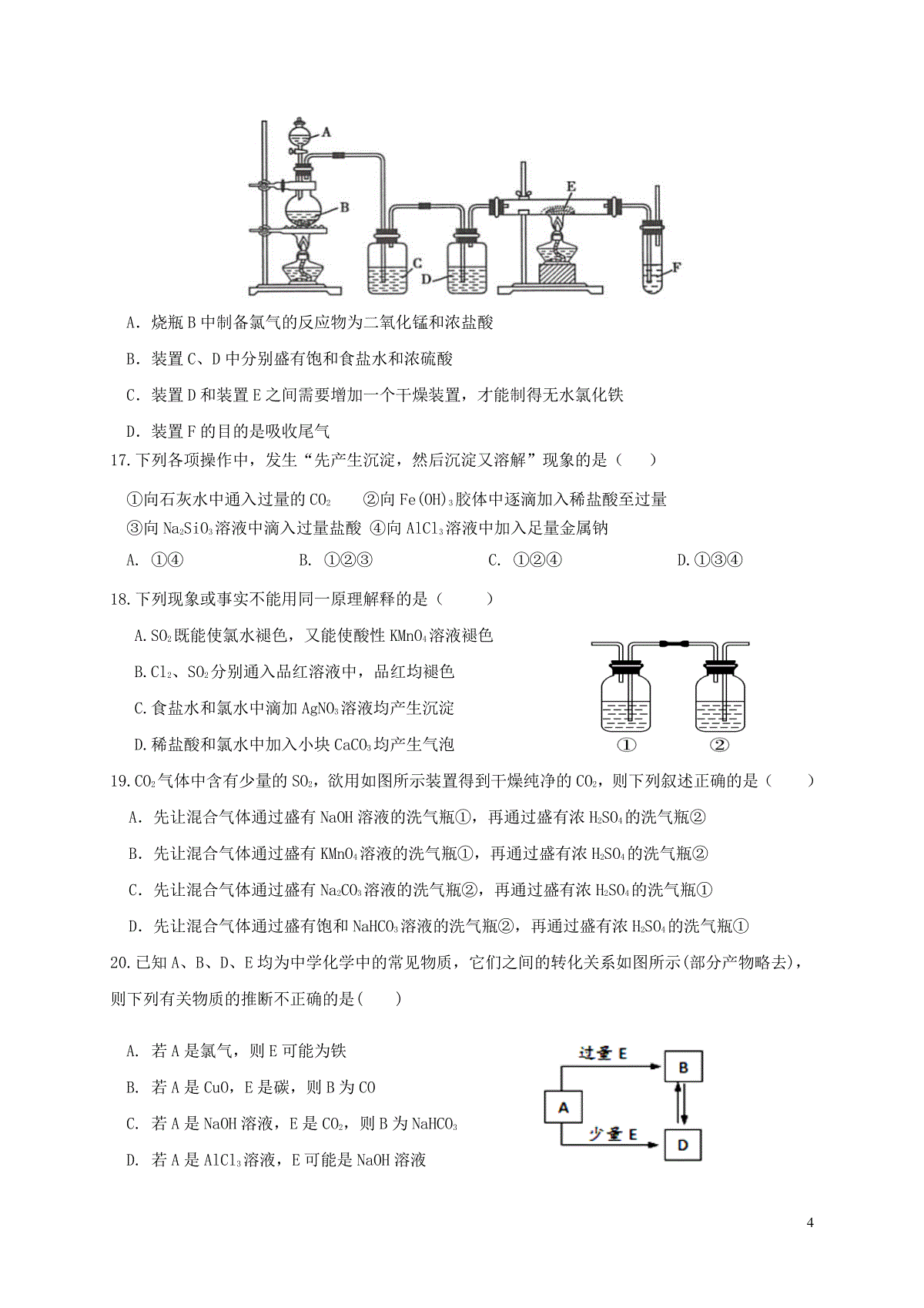
1四川省三台中学实验学校2019-2020学年高一化学上学期期末适应性考试试题本试卷分为试题卷和答题卡两部分,其中试题卷由第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)组成。满分100分,考试时间100分钟。可能用到的相对原子质量:H1C12N14O16Na23Mg24Al27S32Cl35.5Fe56Cu64第Ⅰ卷(选择题,共50分)一、选择题(本题包括25小题,每小题2分,共50分。每小题只有一个选项符合题意)1.下列材料不属于合金的是()A.青铜B.硬铝C.生铁D.磁铁矿2.关于胶体的性质与应用,相关说法错误的是()A.胶粒不能透过半透膜,血液透析利用半透膜将有害物质移出体外B.明矾净水是利用胶体的丁达尔效应C.微粒直径1nm-100nm的纳米材料不是胶体D.将FeCl3饱和溶液滴入沸水,继续加热至溶液呈红褐色,可制备Fe(OH)3胶体3.下列说法正确的是()A.KClO3和NH3溶于水后能导电,故KClO3和NH3为电解质B.25℃时,0.1mol·L-1的醋酸溶液比等浓度的醋酸钠溶液的导电能力弱C.NaHSO3的电离方程式为NaHSO3=Na++H++SO32-D.BaSO4的水溶液不易导电,故BaSO4是弱电解质4.下列叙述中正确的是()A.蒸馏时常用球形冷凝管,冷凝效果更好B.向某溶液中加入CCl4,CCl4层显紫红色,证明原溶液中存在I-C.NaCl溶液蒸发结晶时,蒸发皿中有晶体析出并剩余少量液体即停止加热D.常用将CuSO4溶液蒸干的方法制取CuSO4・5H2O5.下列化学反应属于阴影3区域的是()A.4NO2+O2+2H2O=4HNO3B.Fe+CuSO4=FeSO4+Cu2C.CH4+2O2点燃CO2+2H2OD.2H2O22MnO2H2O+O2↑6.《环境空气质量标准》将PM2.5纳入强制监测指标,迄今为止,中国空气污染物监测指标应包括:①二氧化硫、②一氧化碳、③二氧化氮、④可吸入颗粒物(PM10)、⑤PM2.5。上述5种检测物中,能形成酸雨的是()A.①③B.①②③C.④⑤D.①②④⑤7.下列物品主要含氧化铝的是()A.砖瓦B.耐火坩埚C.玛瑙手镯D.水晶镜片8.下列关于实验室保存药品的方法不正确的是()A.金属钠保存在石蜡油或煤油中B.氢氟酸保存在塑料瓶中C.氯水保存在棕色细口瓶中D.NaOH溶液保存在磨口玻璃瓶中9.欲进行下列实验,其方案设计合理的是()ABCD检验装置气密性实验室制备Fe(OH)2SO2的吸收钠在空气中燃烧10.己知酸性溶液中还原性的强弱顺序为SO32一>I一Fe2+Br一C1一,下列反应不能发生的是()A.2Fe2++I2=2Fe3++2I一B.2Br2+SO32-+H2O=SO42-+2Br一+2H+C.2Fe3++SO32-+H2O=2Fe2++SO42-+2H+D.I2+SO32-+H2O=SO42-+2I一+2H+11.下列离子方程式书写正确的是()A.FeSO4溶液与稀硫酸、双氧水混合:2Fe2++H2O2+2H+==2Fe3++2H2OB.氯化钡溶液中通入少量SO2:SO2+Ba2++H2O==BaSO3↓+2H+C.向NaAlO2溶液中通入过量CO2:2A1O2-+CO2+3H2O==2A(OH)3↓+CO32-D.向KHCO3溶液中加入足量Ba(OH)2溶液:Ba2++2HCO3-+2OH-==2H2O+BaCO3↓+CO32-12.用NA表示阿伏加德罗常数的值。下列叙述中正确的是()A.常温常压下,17gOH—所含电子数为9NA3B.1mol纯H2SO4中离子数目为3NAC.28gC2H4和CO的混合气体中含有的分子数为NAD.标准状况下,11.2LO2与足量Na常温或加热反应,转移的电子数一定为2NA13.下列叙述正确的是()A.向某溶液中滴加氢氧化钠溶液产生白色沉定,且颜色逐渐变为红褐色,说明该溶液中只含有Fe2+B.向碳酸钠和碳酸氢钠溶液中逐滴滴加盐酸,立即有大量气泡产生C.某无色溶液中加入BaCl2溶液,有白色沉淀产生,再加稀硝酸,沉淀不消失,说明该溶液中一定含有SO42-D.某溶液中滴加KSCN溶液,溶液不变红,再滴加氯水,变红,说明该溶液中一定含有Fe2+14.常温下,下列各组离子一定能在指定溶液中大量共存的是()A.与Al反应能放出H2的溶液中:HCO-3、K+、NO-3、SO42-B.能使石蕊试液变红的溶液中:Ba2+、Cu2+、NO-3、Cl-C.含大量NaHSO4的溶液中:Na+、Ba2+、OH-、NO-3D.溶液呈强碱性的溶液中:K+、Mg2+、Cl-、SO32-15.有一包白色粉末,其中可能含有Ba(NO3)2、CaCl2、K2CO3,现做以下实验:①将部分粉末加入水中,振荡,有白色沉淀生成;②向①的悬浊液中加入过量稀盐酸,白色沉淀消失,并有气泡产生;③取少量②的溶液滴入AgNO3溶液,有白色沉淀生成。下列关于白色粉末组成的判断正确的是()A.肯定含有CaCl2、K2CO3,可能含有Ba(NO3)2B.肯定含有Ba(NO3)2、K2CO3,可能含有CaCl2C.肯定含有K2CO3,至少含有Ba(NO3)2和CaCl2中的一种D.Ba(NO3)2、CaCl2、K2CO3都存在16.利用下列装置可以制备无水氯化铁。下列有关说法不正确的是()4A.烧瓶B中制备氯气的反应物为二氧化锰和浓盐酸B.装置C、D中分别盛有饱和食盐水和浓硫酸C.装置D和装置E之间需要增加一个干燥装置,才能制得无水氯化铁D.装置F的目的是吸收尾气17.下列各项操作中,发生“先产生沉淀,然后沉淀又溶解”现象的是()①向石灰水中通入过量的CO2②向Fe(OH)3胶体中逐滴加入稀盐酸至过量③向Na2SiO3溶液中滴入过量盐酸④向AlCl3溶液中加入足量金属钠A.①④B.①②③C.①②④D.①③④18.下列现象或事实不能用同一原理解释的是()A.SO2既能使氯水褪色,又能使酸性KMnO4溶液褪色B.Cl2、SO2分别通入品红溶液中,品红均褪色C.食盐水和氯水中滴加AgNO3溶液均产生沉淀D.稀盐酸和氯水中加入小块CaCO3均产生气泡19.CO2气体中含有少量的SO2,欲用如图所示装置得到干燥纯净的CO2,则下列叙述正确的是()A.先让混合气体通过盛有NaOH溶液的洗气瓶①,再通过盛有浓H2SO4的洗气瓶②B.先让混合气体通过盛有KMnO4溶液的洗气瓶①,再通过盛有浓H2SO4的洗气瓶②C.先让混合气体通过盛有Na2CO3溶液的洗气瓶②,再通过盛有浓H2SO4的洗气瓶①D.先让混合气体通过盛有饱和NaHCO3溶液的洗气瓶②,再通过盛有浓H2SO4的洗气瓶①20.已知A、B、D、E均为中学化学中的常见物质,它们之间的转化关系如图所示(部分产物略去),则下列有关物质的推断不正确的是()A.若A是氯气,则E可能为铁B.若A是CuO,E是碳,则B为COC.若A是NaOH溶液,E是CO2,则B为NaHCO3D.若A是AlCl3溶液,E可能是NaOH溶液521.在100mL1.0mol/L的AlCl3溶液中加入350mL1.0mol/L的NaOH溶液充分反应后,得到沉淀的质量是()A.3.9gB.7.8gC.15.6gD.0g22.在体积相同的两个密闭容器中分别充满NO2、N2O4气体,当这两个容器内温度和气体密度都相等时,下列说法正确的是()A.两种气体的氧原子数相等B.NO2比N2O4的质量小C.两种气体的分子数相等D.两种气体的压强相等23.工业上可利用反应Na2CO3+2Na2S+4SO2===3Na2S2O3+CO2制取化工原料Na2S2O3,下列说法正确的是()A.该反应中SO2还原性大于CO2B.氧化产物与还原产物的质量比为2:1C.每生成1molCO2,转移2NA个电子D.标准状况下,反应中每吸收4molSO2就会放出22.4LCO224.一只试管中NO、NO2、O2以不同的体积比混合,将试管倒立于一盛有足量水的水槽中,水能充满试管的是()A.1:1:2B.9:6:1C.8:4:7D.4:2:325.3.04g某铁的氧化物Fe0.8O溶于足量盐酸中,向所得溶液中通入标准状况下足量的Cl2(还原产物为Cl-),恰好将其中的Fe2+完全氧化为Fe3+,参加反应的Cl2的体积为()A.112mLB.224mLC.336mLD.448mL第Ⅱ卷(非选择题,共50分)二、(本题包括5小题,共50分)26.(7分)若将SO2通入硝酸钡溶液中,有白色沉淀产生,其化学反应方程式如下(未配平):SO2+Ba(NO3)2+H2O——BaSO4↓+HNO3+NO↑(1)配平上述化学反应方程式并用双线桥表示电子转移的方向和数目。(2)该反应中,发生氧化反应,氧化剂是。氧化产物与还原产物的物质的量之比为。(3)当反应消耗二氧化硫19.2g时,反应中转移电子数目为,生成NO的体积6为(标准状况)。27.(5分)净水剂能够改善水质,给人们的生活、健康带来很大的益处。(1)明矾是常见的净水剂。其在水中的电离方程式为;(2)碱式氯化铝(简称BAC)是高效净水剂的主要成分。实验室模拟利用铝土矿(主要含Al2O3,还含少量Fe2O3及其他不溶杂质)制取碱式氯化铝[Al2(OH)nCl6-n]的过程如下:①盐酸溶解铝土矿过程中,发生反应的离子方程式为、;②加适量铝粉的主要作用是。③蒸发浓缩所需玻璃仪器为。28.(8分)晶体硅是一种重要的非金属材料,制备高纯硅的一种工业流程如下:(1)制备粗硅(反应①)的化学反应方程式为。(2)已知SiHCl3能与H2O强烈反应,在空气中易自燃。粗硅与HCl反应完全后,经冷凝得到的SiHCl3(沸点33.0℃)中含有少量SiCl4(沸点57.6℃)和HCl(沸点-84.7℃),提纯SiHCl3采用的方法为。(3)H2还原SiHCl3过程中若混入O2,可能引起的后果是,反应③的化学方程式是。(4)整个生产过程中,可以循环利用的气体是,高纯硅的一种用途是。石英砂粗硅SiHCl3(粗)HCl300℃高纯硅CO焦炭高温1080℃SiHCl3(纯)提纯H2HClH2①②③729.(9分)实验室需要480mL0.1mol·L-1的硫酸铜溶液,现按以下步骤进行配制:(1)配制主要步骤有:计算→称量→→转移→→定容→摇匀。(2)计算需要胆矾(CuSO4·5H2O)的质量为g。(3)在该实验中要用到玻璃仪器除玻璃棒外还有_________,使用容量瓶前首先要。(4)以下操作会导致所配溶液浓度偏高的是。①砝码生锈②容量瓶使用前用蒸馏水洗净后未烘干③烧杯中的溶液转移到容量瓶后,未用蒸馏水洗涤烧杯④定容时俯视观察液面⑤定容时不小心加水超过刻度线,用滴管吸出多余溶液(5)所配溶液经测定密度为1.25g/mL,则该溶液中溶质的质量分数为______%30.(13分)某课外小组欲探究在适当温度和催化剂的条件下,SO2与O2反应后混合气体的成分。已知:①沸点:SO2−10℃,SO345℃;②SO3遇水反应,放出大量热,产生酸雾;③98.3%H2SO4可以吸收SO3和酸雾。提供的药品:Na2SO3固体、10mol·L−1H2SO4、催化剂(V2O5)、KMnO4溶液、蒸馏水、0.5mol·L−1BaCl2溶液、98.3%H2SO4、2.0mol·L−1NaOH溶液、品红溶液等。(1)该小组同学用Na2SO3固体与10mol·L-1H2SO4混合制取SO2。发生装置应该选用下图中________装置(填字母)。(2)该小组同学为检验反应后混合气体的成分,设计如下装置:8①b中发生反应的化学方程式是。②c中盛放的试剂是,出现的现象是;e中盛放的试剂是,其作用是。③某同学提出用饱和的NaHSO3溶液代替98.3%的浓H2SO4,请你评价该方案是否可行。是否可行:_________(填“是”或者“否”),理由:。(若可行不必说明理由;若不可行,简述其理由)。。(3)另一同学提出,其它装置盛装药品不变,只将装置e中盛装FeCl3和BaCl2的混合溶液,观察到白色沉淀现象,证明其中一种产物的存在,相关反应的离子方程式



 三七文档所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。
三七文档所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。
本文标题:四川省三台中学实验学校2019-2020学年高一化学上学期期末适应性考试试题
链接地址:https://www.777doc.com/doc-8370210 .html