当前位置:首页 > 中学教育 > 高中教育 > 2021高考化学一轮复习 课后限时集训25 水的电离和溶液的酸碱性 新人教版
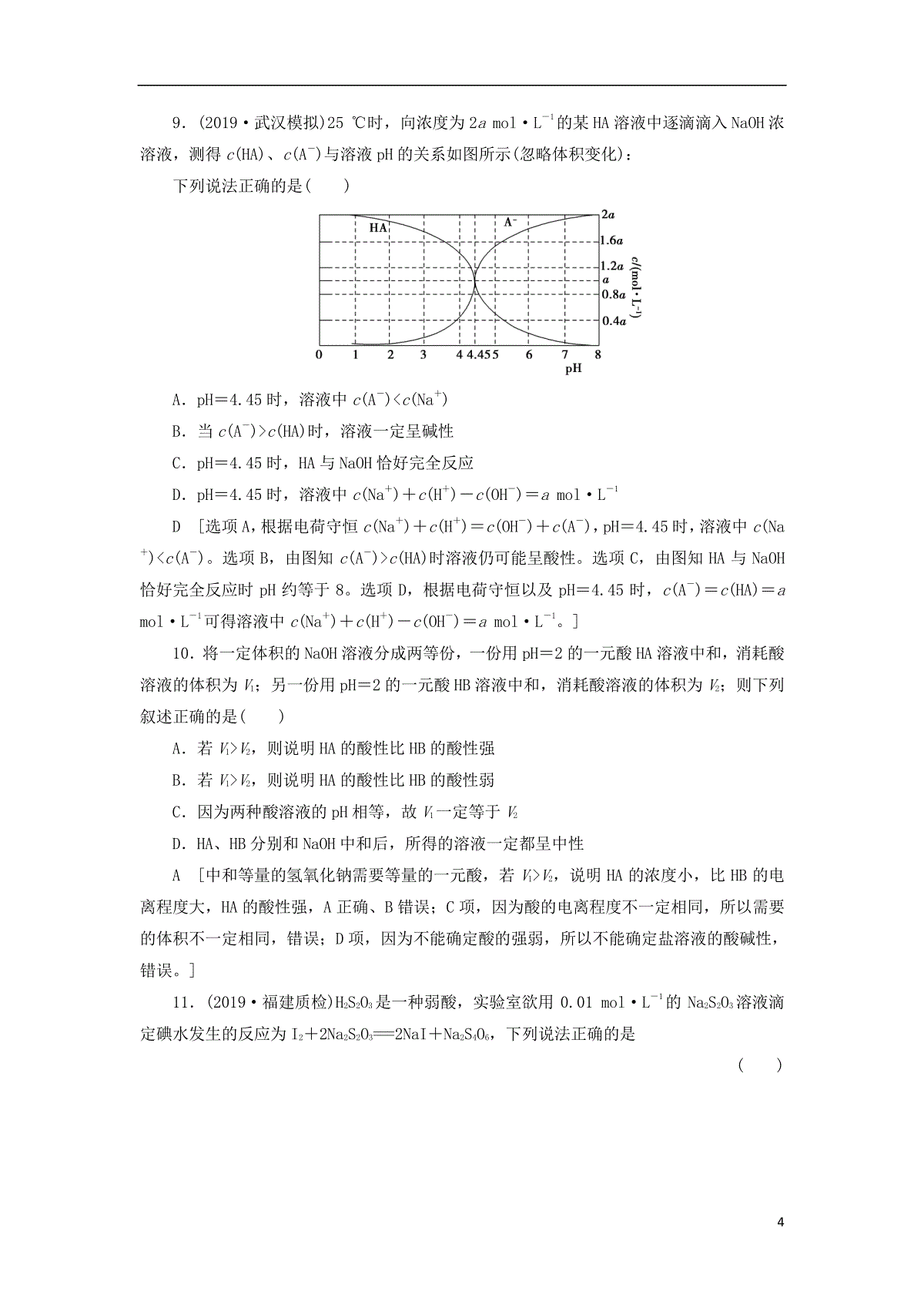
1课后限时集训25水的电离和溶液的酸碱性(建议用时:35分钟)1.下列关于水的说法正确的是()A.常温下正常雨水的pH为7.0,酸雨的pH小于7.0B.将25℃纯水加热至95℃时,Kwc-增大C.将纯水加热到95℃时,水的离子积变大,pH不变,水仍呈中性D.向水中加入醋酸或醋酸钠,均可促进水的电离B[正常雨水的pH为5.6,酸雨的pH小于5.6;将纯水加热后,水的离子积变大,KwcH-=c(H+)变大,pH变小,水仍呈中性;向水中加入醋酸可抑制水的电离,而加入醋酸钠会促进水的电离。]2.(2019·临泉一中模拟)下列操作中,能使电离平衡H2OH++OH-向右移动,且溶液呈酸性的是()A.向水中加入NaHSO4溶液B.向水中加入Na2CO3溶液C.向水中加入Al2(SO4)3固体D.将水加热到100℃,使pH=6[答案]C3.下列说法中正确的是()A.25℃时NH4Cl溶液的Kw大于100℃时NaCl的KwB.常温下,pH均为5的醋酸和硫酸铝两种溶液中,由水电离出的氢离子浓度之比为1∶104C.根据溶液的pH与酸碱性的关系,推出pH=6.8的溶液一定显酸性D.25℃,水电离出的c(H+)H2O=1×10-10mol·L-1的溶液的pH一定为10B[温度越高,Kw越大,A错;pH=6.8的溶液不一定为酸性,C错;c(H+)H2O=1×10-10mol·L-1的溶液pH可能为4或10,D错。]4.(2019·淄博模拟)已知在100℃时水的离子积Kw=1×10-12(本题涉及溶液的温度均为100℃)。下列说法中正确的是()A.0.005mol·L-1的H2SO4溶液,pH=2B.0.001mol·L-1的NaOH溶液,pH=11C.0.005mol·L-1的H2SO4溶液与0.01mol·L-1的NaOH溶液等体积混合,混合溶液的2pH为6,溶液显酸性D.完全中和pH=3的H2SO4溶液50mL,需要pH=9的NaOH溶液100mLA[B项,0.001mol·L-1的NaOH溶液中,c(OH-)=0.001mol·L-1,c(H+)=Kwc-=1×10-121×10-3mol·L-1=1×10-9mol·L-1,pH=-lg(1×10-9)=9;C项,0.005mol·L-1的H2SO4溶液与0.01mol·L-1的NaOH溶液等体积混合,溶液呈中性,pH=6;D项,pH=3的H2SO4溶液c(H+)=10-3mol·L-1,pH=9的NaOH溶液,c(OH-)=10-3mol·L-1,二者完全中和,溶液的体积相等。]5.(2019·潮州模拟)下列说法错误的是()A.常温下,0.1mol·L-1的CH3COOH溶液中,由水电离的c(H+)为10-13mol·L-1B.pH=2与pH=1的CH3COOH溶液中c(H+)之比为1∶10C.常温下,等体积pH=12的NaOH溶液和pH=2的CH3COOH溶液混合,混合后溶液pH7D.某温度时水的离子积常数Kw=1×10-13,若将此温度下pH=11的NaOH溶液aL与pH=1的稀硫酸bL混合,若所得混合液pH=2,则a∶b=9∶2A[25℃时,0.1mol·L-1的CH3COOH溶液的c(H+)0.1mol·L-1,c(H+)H2O10-13mol·L-1。]6.(2019·沈阳模拟)常温下,用等浓度的NaOH溶液分别滴定相同体积的NH4Cl、KH2PO4及CH3COOH溶液,滴定曲线如图所示,下列说法正确的是()A.NH3·H2ONH+4+OH-的lgKb=-9.25B.CH3COOH+HPO2-4===CH3COO-+H2PO-4的lgK=2.11C.0.1mol·L-1KH2PO4溶液中:c(HPO2-4)c(H3PO4)D.在滴定过程中,当溶液pH相同时,消耗NaOH的物质的量:CH3COOHKH2PO4NH4ClB[A项,根据Kb表达式,当c(NH+4)=c(NH3·H2O)时,Kb=c(OH-)=310-14+9.25=10-4.75,lgKb=-4.75,错误;B项,K=KaCH3COOHKaH2PO-4=10-4.7510-6.86=102.11,lgK=2.11,正确;C项,H2PO-4以电离为主,c(HPO2-4)c(H3PO4),错误;D项,根据图示可知,消耗NaOH的量:CH3COOHKH2PO4NH4Cl,错误。]7.(2019·常德二模)已知:常温下,Ksp(CuS)=1.0×10-36,Ksp(HgS)=1.6×10-52;pM=-lgc(M2+)(M表示Cu或Hg)。常温下,向10.0mL0.20mol·L-1Cu(NO3)2溶液中逐滴滴加0.10mol·L-1Na2S溶液,溶液中pM与加入Na2S溶液的体积(V)的关系如图所示。下列说法错误的是()A.V0=20.0mL,m=18B.若c[Cu(NO3)2]=0.01mol·L-1,则反应终点可能为e点C.a、b、d三点中,由水电离的c(H+)和c(OH-)的积最大的为b点D.相同条件下,若用等浓度等体积的Hg(NO3)2溶液代替上述Cu(NO3)2溶液,则反应终点b向c方向移动C[根据曲线可知,b点恰好反应,a点Cu2+过量、d点S2-过量,二者均促进水电离,故b点是水电离的c(H+)和c(OH-)的积最小的点,C错误。]8.(2019·南昌模拟)298K时,在20.00mL0.1mol·L-1C6H5COOH(苯甲酸)溶液中滴加0.1mol·L-1NaOH溶液,溶液中离子浓度与pH关系如图所示。下列说法正确的是()A.a点:溶液中c(Na+)>c(C6H5COO-)>c(H+)>c(OH-)B.b点:对应的NaOH溶液体积为10mLC.对b点溶液加热(不考虑挥发),实现曲线由b点向c点的变化D.298K时,C6H5COOH的电离常数为1×10-4.19D[A项,不符合电荷守恒,错误;B项,根据b点可知Ka=10-4.19,当NaOH溶液体积为10mL时,C6H5COOH中和一半,根据Ka,C6H5COOH电离程度大于C6H5COO-水解程度,lgc6H5COO-c6H5≠0,错误;C项,加热C6H5COOH和CH3COO-,酸性增强,pH减小,错误。]49.(2019·武汉模拟)25℃时,向浓度为2amol·L-1的某HA溶液中逐滴滴入NaOH浓溶液,测得c(HA)、c(A-)与溶液pH的关系如图所示(忽略体积变化):下列说法正确的是()A.pH=4.45时,溶液中c(A-)c(Na+)B.当c(A-)c(HA)时,溶液一定呈碱性C.pH=4.45时,HA与NaOH恰好完全反应D.pH=4.45时,溶液中c(Na+)+c(H+)-c(OH-)=amol·L-1D[选项A,根据电荷守恒c(Na+)+c(H+)=c(OH-)+c(A-),pH=4.45时,溶液中c(Na+)c(A-)。选项B,由图知c(A-)c(HA)时溶液仍可能呈酸性。选项C,由图知HA与NaOH恰好完全反应时pH约等于8。选项D,根据电荷守恒以及pH=4.45时,c(A-)=c(HA)=amol·L-1可得溶液中c(Na+)+c(H+)-c(OH-)=amol·L-1。]10.将一定体积的NaOH溶液分成两等份,一份用pH=2的一元酸HA溶液中和,消耗酸溶液的体积为V1;另一份用pH=2的一元酸HB溶液中和,消耗酸溶液的体积为V2;则下列叙述正确的是()A.若V1V2,则说明HA的酸性比HB的酸性强B.若V1V2,则说明HA的酸性比HB的酸性弱C.因为两种酸溶液的pH相等,故V1一定等于V2D.HA、HB分别和NaOH中和后,所得的溶液一定都呈中性A[中和等量的氢氧化钠需要等量的一元酸,若V1V2,说明HA的浓度小,比HB的电离程度大,HA的酸性强,A正确、B错误;C项,因为酸的电离程度不一定相同,所以需要的体积不一定相同,错误;D项,因为不能确定酸的强弱,所以不能确定盐溶液的酸碱性,错误。]11.(2019·福建质检)H2S2O3是一种弱酸,实验室欲用0.01mol·L-1的Na2S2O3溶液滴定碘水发生的反应为I2+2Na2S2O3===2NaI+Na2S4O6,下列说法正确的是()5A.该滴定反应可用甲基橙作指示剂B.Na2S2O3是该反应的还原剂C.该滴定反应可选用如图所示装置D.该反应中每消耗2molNa2S2O3,转移电子的物质的量为4mol[答案]B12.现有常温下的六份溶液:①0.01mol·L-1CH3COOH溶液;②0.01mol·L-1HCl溶液;③pH=12的氨水;④pH=12的NaOH溶液;⑤0.01mol·L-1CH3COOH溶液与pH=12的氨水等体积混合后所得溶液;⑥0.01mol·L-1HCl溶液与pH=12的NaOH溶液等体积混合后所得溶液。(1)其中水的电离程度最大的是________(填序号,下同),水的电离程度相同的是________。(2)若②③混合后所得溶液的pH=7,则消耗溶液的体积:②________③。(填“”“”或“=”)(3)将六份溶液稀释相同倍后,溶液的pH:①______②,③________④,⑤________⑥(填“”“”或“=”)。(4)将①④混合,若有c(CH3COO-)c(H+),则混合溶液可能呈________(填字母)。A.酸性B.碱性C.中性(5)25℃时,有pH=x的盐酸和pH=y的氢氧化钠溶液(x≤6,y≥8),取aL该盐酸与bL该氢氧化钠溶液反应,恰好完全中和,求:①若x+y=14,则a/b=________(填数据);②若x+y=13,则a/b=________(填数据);③若x+y14,则a/b=________(填表达式)。[解析](1)酸和碱都会抑制水的电离,故只有⑥(NaCl溶液)对H2O的电离无抑制作用。②③④对水的电离抑制程度相同。(2)因pH=12的氨水中c(NH3·H2O)0.01mol·L-1,故②③混合,欲使pH=7,则需体6积②③。(3)稀释相同的倍数后,溶液的pH:①②;③④;⑤⑥。(4)由电荷守恒知:c(Na+)+c(H+)=c(CH3COO-)+c(OH-),仅知道c(CH3COO-)c(H+),溶液酸碱性均有可能存在,故选ABC。(5)若两溶液完全中和,则溶液中n(H+)=n(OH-),即10-xa=10y-14b,整理得ab=10x+y-14,①若x+y=14,ab=1;②若x+y=13,则ab=0.1;③若x+y14,则ab=10x+y-14。[答案](1)⑥②③④(2)(3)(4)ABC(5)①1②0.1③10x+y-1413.(2019·湖北八校联考)25℃时,取未知浓度的硫酸、盐酸和醋酸各25.00mL,分别用0.10mol·L-1的NaOH溶液或0.10mol·L-1的稀氨水滴定得如图所示曲线。下列说法正确的是()A.由图可知曲线c为NaOH滴定硫酸B.由图可知硫酸的物质的量浓度大于盐酸的物质的量浓度C.曲线b、c的滴定实验可用酚酞作指示剂D.由图可知滴定前醋酸电离百分比约为1.67%D[由图知,加入氨水或NaOH溶液后,a的pH在开始阶段变化大,应为碱滴定弱酸的变化曲线,则b、c为硫酸或盐酸的变化曲线。由于不知浓度,所以无法确定b、c;用氨水滴定盐酸或硫酸,终点显酸性,应用甲基橙作指示剂,A、C均错误;硫酸、盐酸都为强酸,题中纵坐标为pH,不能确定物质的量浓度大小,B错误。][教师用书独具](2019·四省名校大联考)草酸(H2C2O4)是一种二元弱酸,在菠菜、苋菜、甜菜等植物中含量较高。25℃时,向H2C2O4溶液中滴加NaOH溶液,混合溶液中lgX[X表示c(HC2O-4)/c(H2C2O4)或c(C2O2-4)/c(HC2O-4)]随pH的变化关系如图所示。下列说法不正确的是()7A.直线Ⅰ中X表示的是c(HC2O-4)/c(H2C2O4)B.直线Ⅰ、Ⅱ的斜率均为1C.0.1mol/LNaHC2O4溶液中:c(H2C2O4




 三七文档所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。
三七文档所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。
本文标题:2021高考化学一轮复习 课后限时集训25 水的电离和溶液的酸碱性 新人教版
链接地址:https://www.777doc.com/doc-8371466 .html