当前位置:首页 > 建筑/环境 > 工程监理 > 高三化学无机元素解题方法
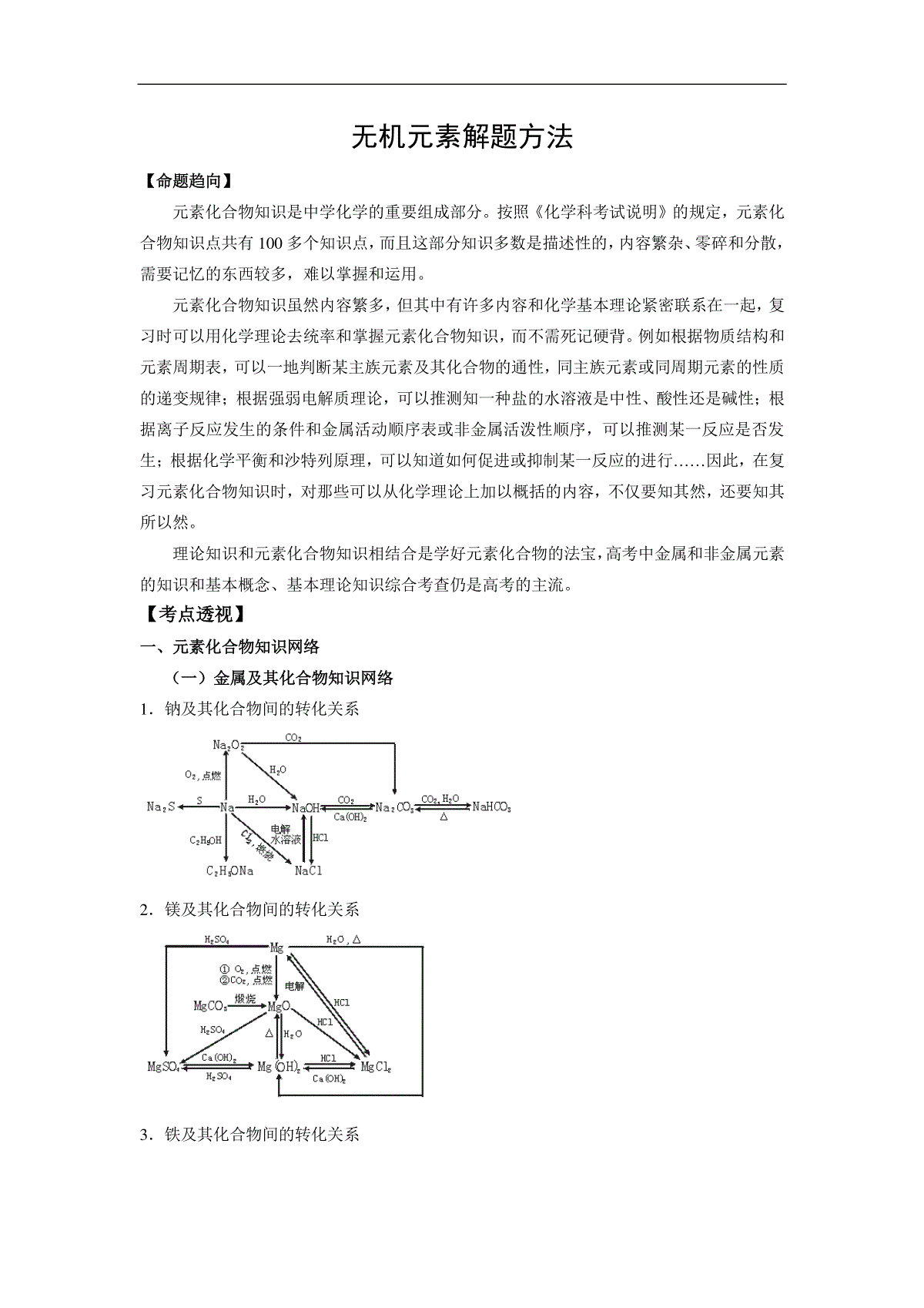
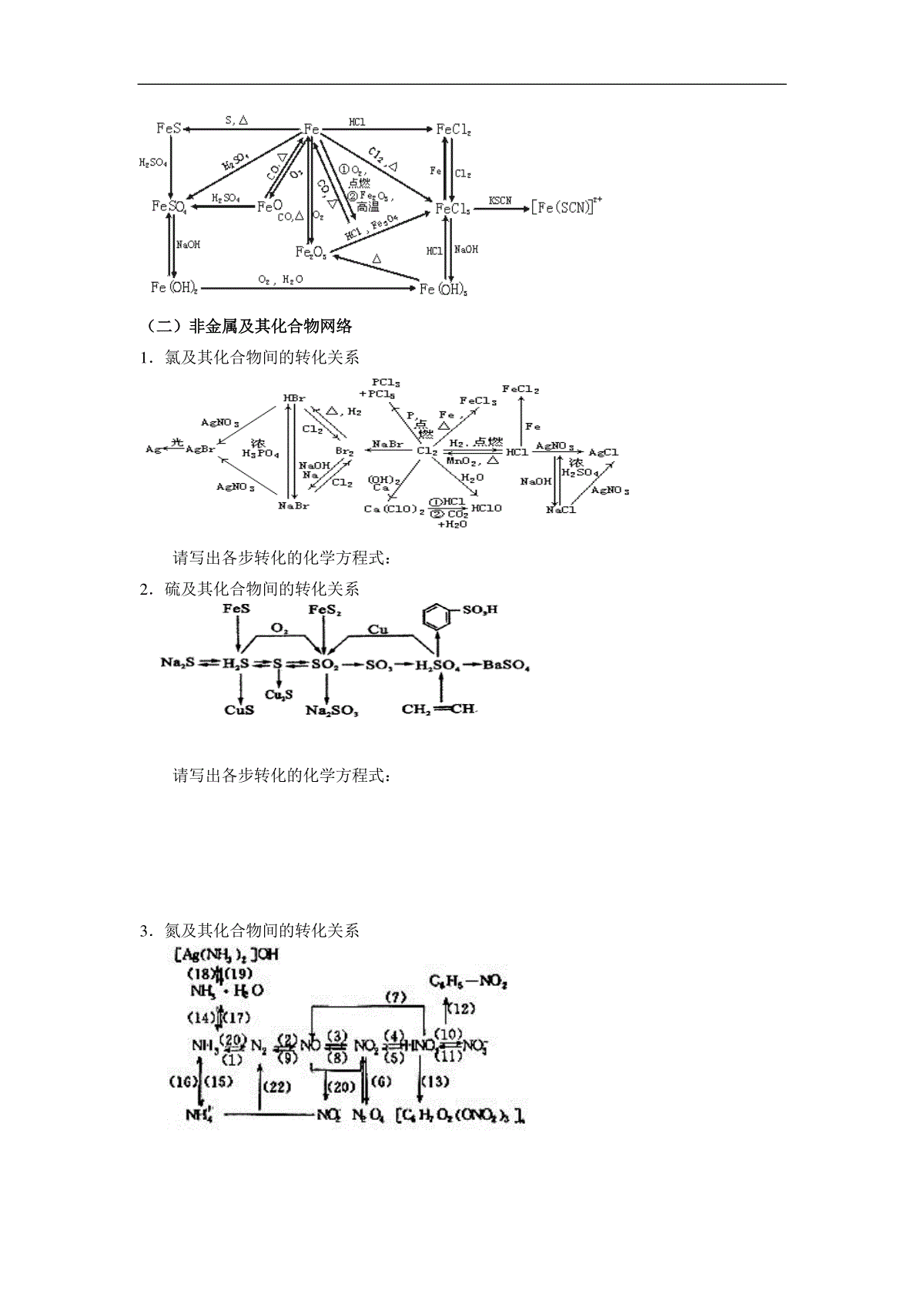
无机元素解题方法【命题趋向】元素化合物知识是中学化学的重要组成部分。按照《化学科考试说明》的规定,元素化合物知识点共有100多个知识点,而且这部分知识多数是描述性的,内容繁杂、零碎和分散,需要记忆的东西较多,难以掌握和运用。元素化合物知识虽然内容繁多,但其中有许多内容和化学基本理论紧密联系在一起,复习时可以用化学理论去统率和掌握元素化合物知识,而不需死记硬背。例如根据物质结构和元素周期表,可以一地判断某主族元素及其化合物的通性,同主族元素或同周期元素的性质的递变规律;根据强弱电解质理论,可以推测知一种盐的水溶液是中性、酸性还是碱性;根据离子反应发生的条件和金属活动顺序表或非金属活泼性顺序,可以推测某一反应是否发生;根据化学平衡和沙特列原理,可以知道如何促进或抑制某一反应的进行……因此,在复习元素化合物知识时,对那些可以从化学理论上加以概括的内容,不仅要知其然,还要知其所以然。理论知识和元素化合物知识相结合是学好元素化合物的法宝,高考中金属和非金属元素的知识和基本概念、基本理论知识综合考查仍是高考的主流。【考点透视】一、元素化合物知识网络(一)金属及其化合物知识网络1.钠及其化合物间的转化关系2.镁及其化合物间的转化关系3.铁及其化合物间的转化关系(二)非金属及其化合物网络1.氯及其化合物间的转化关系请写出各步转化的化学方程式:2.硫及其化合物间的转化关系请写出各步转化的化学方程式:3.氮及其化合物间的转化关系4.碳及其化合物间的转化关系二.元素化合物特征现象:1.焰色反应:Na+(黄色)、K+(紫色)2.浅黄色固体:S或Na2O2或AgBr3.有色溶液:Fe2+(浅绿色)、Fe3+(黄色)、Cu2+(蓝色)、MnO4-(紫色)有色固体:红色(Cu、Cu2O、Fe2O3)、红褐色[Fe(OH)3]蓝色[Cu(OH)2]黑色(CuO、FeO、FeS、CuS、Ag2S、PbS)黄色(AgI、Ag3PO4)白色[Fe(0H)2、CaCO3、BaSO4、AgCl、BaSO3]有色气体:Cl2(黄绿色)、NO2(红棕色)4.特征反应现象:])([])([32OHFeOHFe红褐色白色沉淀空气5.既产生淡黄色沉淀又产生刺激性气味的气体:S2O32-+2H+=S↓+SO2↑+H2O(Na2S2O3+H2SO4)6.溶液颜色变为浅绿色,并产生淡黄色沉淀:2FeCl3+H2S=2FeCl2+S↓+2HCl7.通CO2变白色浑浊:石灰水(过量变清)、Na2SiO3、饱和Na2CO3、浓苯酚钠、NaAlO2三、金属基本反应:1.与水反应产生气体或沉淀:(1)单质22222422222OHFOHFHNaOHOHNa(2)化合物22222232323222322222326233422HCOHCaOHCaCSHOHAlOHSAlNHOHMgOHNMgONaOHOHONa(3)双水解:32322323233222OHAlAlOOHAlSHHSSOHAlCOHCOCOAlOHOHOH与2.既能酸反应,又能与碱反应(1)单质:Al、Si20090318(2)化合物:Al2O3、Al(OH)3、弱酸弱碱盐、弱酸的酸式盐、氨基酸。如:Al3+Al(OH)3AlO2-(3)A—CB气体气体强碱强酸3.置换反应:(1)金属→金属铝热反应盐金属盐金属.2.1(2)金属→非金属CMgOCOMgHFeMgNaOHH22222点燃或)、、活泼金属(4.分解反应:(1)233222OKClKClOMnO,(2)硝酸盐223222322242)(2ONOAgAgNOONOCuONOCu(3)电解反应:电解22223222HOHOAlOAlONaClNaOHClH电解电解电解如电解硫酸钠、氢氧化钠溶液)熔融溶液四、非金属知识归纳1.非金属单质或化合物的反应中常用到催化剂的反应:322223322222223645422222NHHNOHNOONHSOOSOOOHOHMnO催化剂,催化剂,催化剂,2.置换反应:(1)非金属→非金属)、(、高温高温HIHBrHClSSHIBrClHCOOHCCOSiSiOCOHFOHF2)(224222222222222(2)非金属→金属222COCOHH金属金属氧化物金属金属氧化物高温高温3.归中反应:2H2S+SO2=3S+2H2O4NH3+6NO催化剂4N2+6H2O4.分解反应:受热分解产生2种或3种气体的反应:铵盐SHNHSNHHSNHOHSONHSONHHSONHOHCONHCONHHCONH232442233243422332434])[(])[(])[(5.特征网络:通式:)(222酸或碱DCBAOHOO①323222HNONONONHOHOO(气体)②42322222SOHSOSOSHOHOO(气体)③322222COHCOCOCOHOO(固体)④NaOHONaONaNaOHOO222222(固体)6.特征反应(1)与碱反应产生气体①232222222232222HSiONaOHNaOHSiHNaAlOOHNaOHAlHSiAlOH、单质②铵盐:OHNHNH234碱(2)与酸反应产生气体①2222222222342342342NOSOSOSCONOCOSOCNONOSOHHNOSOHHNOSOHHNOSOHHCl、、、非金属、金属单质浓浓浓浓浓20090318②2323222323SOHSOSOSHHSSCOHCOCOHHH化合物【例题解析】例1.实验室用浓盐酸与二氧化锰反应制取氯气,下列有关说法中正确的是(气体体积在标准状况下测定)()A.若提供0.4molHCl,MnO2不足量,则可制得氯气2.24LB.若提供0.4molHCl,MnO2过量,则可制得氯气2.24LC.若有0.4molHCl参与反应,则可制得氯气2.24LD.若有0.4molHCl被氧化,则可制得氯气2.24L解析:实验室制取氯气是用二氧化锰与浓盐酸反应,与稀盐酸是不反应的,浓盐酸在反应一段时间后变稀就不能再与二氧化锰反应了,所以当HCl的物质的量为0.4mol时,无论如何都不可能完全反应生成0.1mol氯气。提供的HCl分为3部分——没有参加反应的、参加反应且被氧化的和参加反应但没有被氧化的。答案:C例2.某混合气体可能有CO、CO2、NH3、HCl、H2和水蒸气中的一种或几种,当依次通过澄清石灰水(无浑浊现象)、氢氧化钡溶液(有浑浊现象)、浓硫酸、灼热的氧化铜(变红)和无水硫酸铜(变蓝)时,则可断定该混合气中一定有()A.HCl、CO2、H2B.CO、H2、H2OC.CO、H2、NH3D.HCl、CO、H2O解析:气体通过澄清石灰水无浑浊,而通过Ba(OH)2溶液有浑浊,则证明原混合气体中一定含HCl和CO2气体,因HCl与石灰水作用:Ca(OH)2+2HCl==CaCl2+2H2O,无沉淀产生,且HCl被吸收;CO2通过Ba(OH)2产生沉淀:Ba(OH)2+CO2==BaCO3↓+H2O,因而有HCl、CO2,则一定没有NH3。通过灼热的CuO和无水CuSO4所呈现的现象说明一定存在H2。答案:A例3.在容积为672mL的烧瓶里充满NO、NO2的混合气体,将其倒立在水槽里,去塞后再通入280mL氧气,恰好完全反应,且水充满烧瓶(气体体积都折合成标准状况下)。下列有关叙述中,正确的是()A.总反应为NO+NO2+O2+H2O==2HNO3B.总反应为4NO+8NO2+5O2+6H2O==12HNO3C.生成HNO3的物质的量浓度接近0.03mol·L-1D.生成HNO3的物质的量浓度约为0.045mol·L-1解析:本题考查NO、NO2的混合气体与氧气在水中反应的比例关系。无论是NO还是NO2都能在水中与氧气按一定比例反应生成HNO3,同温同压下,气体物质的量之比等于体积之比,n(NO+NO2)︰n(O2)=672︰280=12︰5。所以由电子守恒可知恰好反应时总反应为4NO+8NO2+5O2+6H2O==12HNO3。可以生成0.03molHNO3,容器容积为672mL,所以硝酸溶液浓度=0.03mol/0.672L=0.045mol·L-1。答案:BD例4.足量铜与一定量浓硝酸反应,得到硝酸铜溶液和NO2、N2O4、NO的混合气体,这些气体与1.68LO2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸。若向所得硝酸铜溶液中加入5mol/LNaOH溶液至Cu2+恰好完全沉淀,则消耗NaOH溶液的体积是__________。解析:利用电子守恒是解答本题的关键。本题的本质是参加反应的铜失去电子与氧气得电子总数相等,设参加反应的铜的物质的量为X,则2×X=4×1.68/22.4,解答X=0.15mol,因而消耗NaOH溶液的体积为2×0.15mol/5mol/L=0.06L=60mL。例5.(08全国Ⅱ卷)对于ⅣA族元素,下列叙述中不正确的是()A.SiO2和CO2中Si和O,C和O之间都是共价键B.C、Si、Ge的最外层电子数都是4,次外层电子数都是8C.CO2和SiO2都是酸性氧化物,在一定条件下都能和氧化钙反应D.该族元素的主要化合价是-4和+2解析:ⅣA族元素最外层电子数都是4,但C原子的次外层电子数只有2个电子。答案:B。例6.(08北京卷)1mol过氧化钠与2mol碳酸氢钠固体混合后,在密闭的容器中加热充分反应,排出气体物质后冷却,残留的固体物质是()A.Na2CO3B.Na2O2Na2CO3C.NaOHNa2CO3D.Na2O2NaOHNa2CO3解析:根据反应式:2NaHCO3=Na2CO3+CO2+H2O,2Na2O2+2H2O=4NaOH+O2,2Na2O2+2CO2=2Na2CO3+O2;根据计量关系,可知2molNaHCO3生成CO2和H2O各1mol,Na2O2只有1mol,故其恰好和CO2反应生成Na2CO3和O2,气体排出后,只剩余Na2CO3。答案:A例7.已知2Fe2++Br2=2Fe3++2Br-,当向100mL的FeBr2溶液中通入标准状况下的Cl23.36L,充分反应后测得形成的溶液中Cl-和Br-的物质的量浓度相等,则原FeBr2溶液的物质的量浓度为___________________。解析:由题供信息可知:Fe2+的还原性强于Br-的还原性;因此,通入Cl2后Fe2+应该全部被氧化成了Fe3+。据题意知反应后的溶液中只有Fe3+、Cl-、Br-,且n(Cl-)=n(Br-)=2n(Cl2)=2×3.36L/22.4L·mol-1=2×0.15mol。据电荷守恒原理,必有:3n(Fe3+)=n(Cl-)×1+n(Br-)×1解得:n(Fe3+)=0.2mol又由铁元素守恒知n(Fe2+)=n(Fe3+)=0.2mol。故原FeBr2溶液的物质的量浓度为:0.2mol/0.1L=2mol/L例8.由A、D、E、G四种微粒组成的盐可表示为xAaDd·yE



 三七文档所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。
三七文档所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。
本文标题:高三化学无机元素解题方法
链接地址:https://www.777doc.com/doc-1933861 .html