当前位置:首页 > 商业/管理/HR > 其它文档 > 大连理工2004年物理化学(上)期末考试试卷A卷及答案
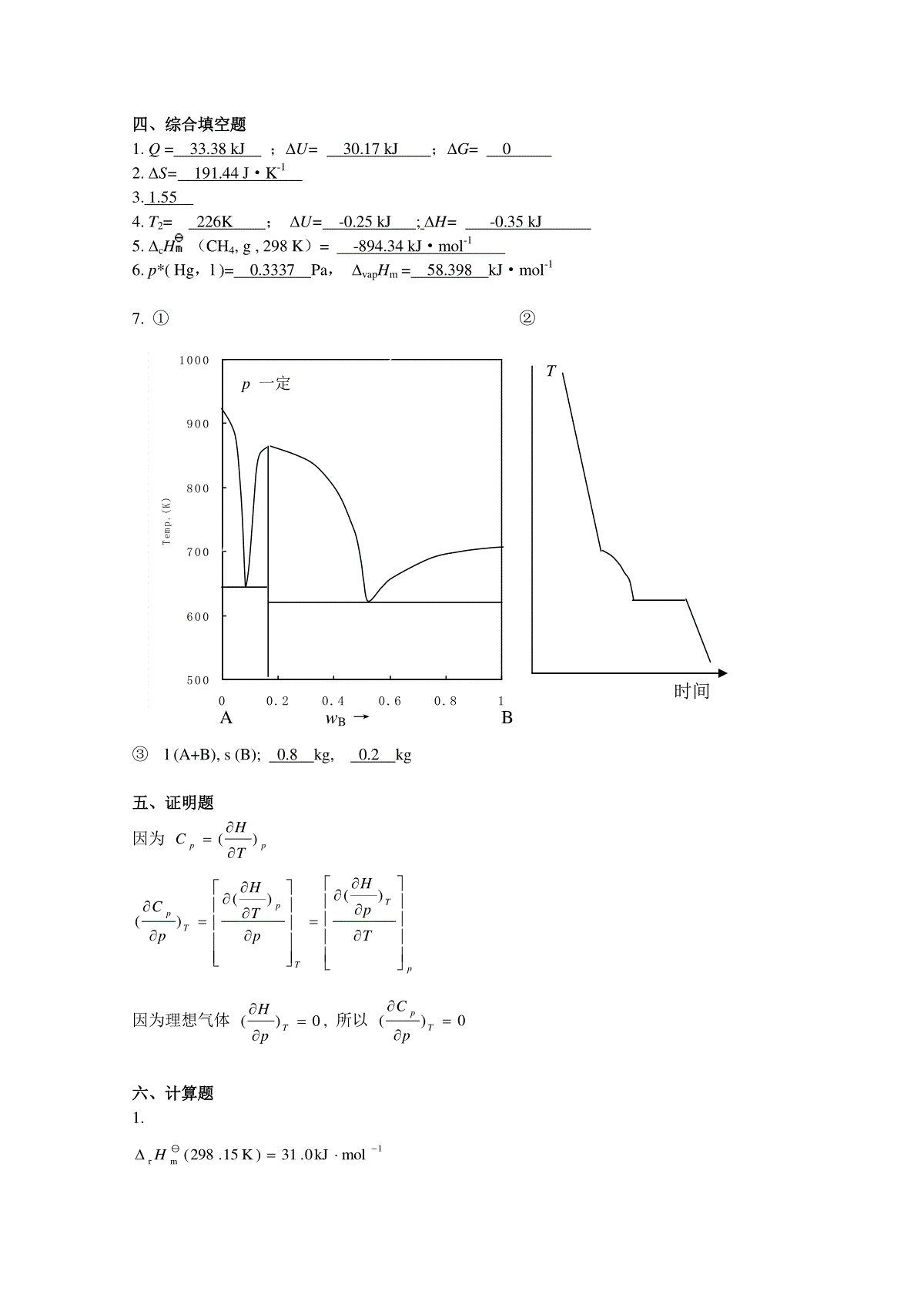
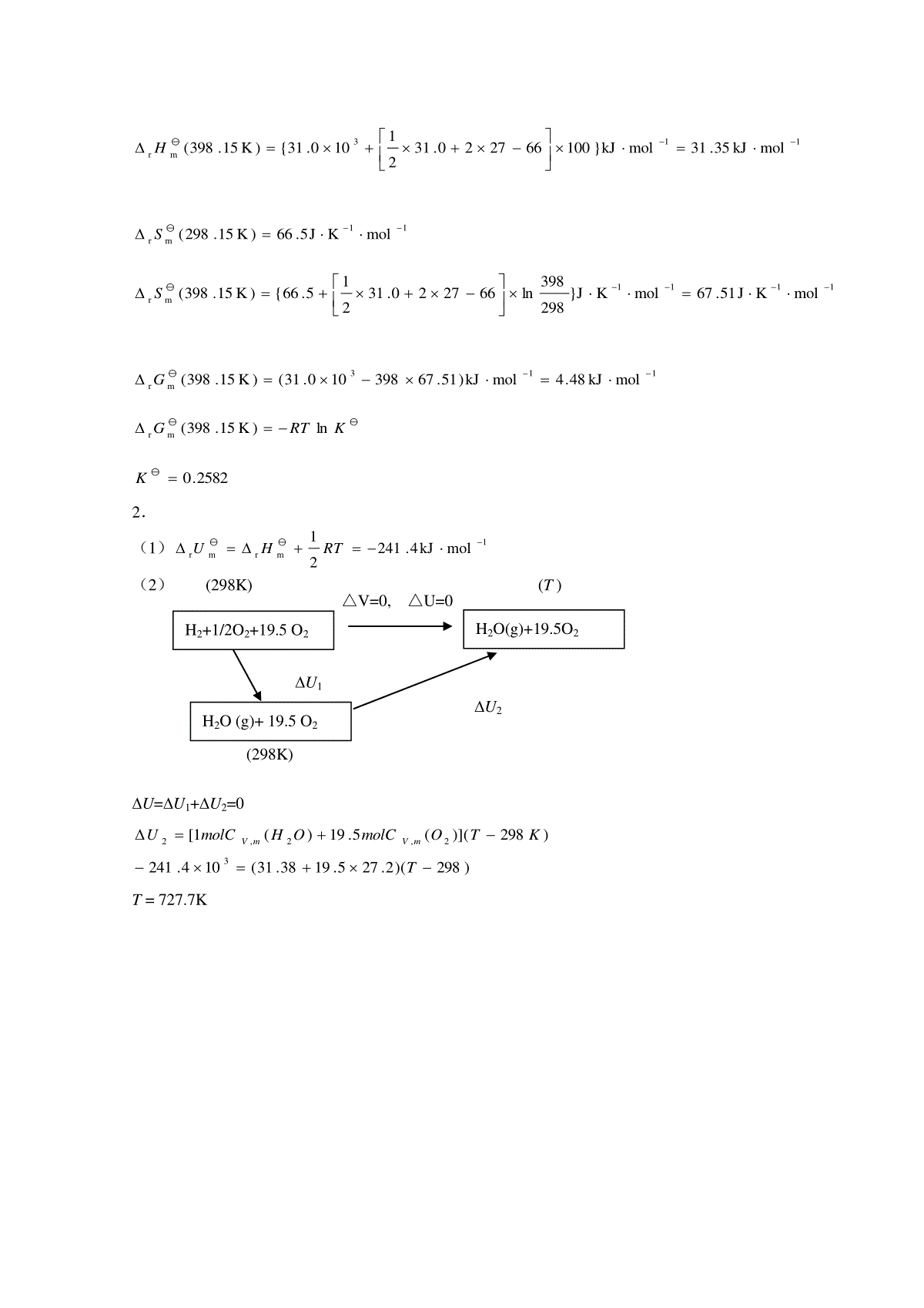
一、是非题[]1.如果经一过程系统的熵变大于0,则系统所经历的该过程必为不可逆过程。[]2.不可能用简单精馏的方法将二组分恒沸混合物分离为两个纯组分。[]3.化学反应的标准平衡常数K与反应压力无关。[]4.在定温定压下,CO2由饱和液体转变为饱和蒸气,因温度不变,CO2的热力学能和焓也不变。[]5.纯水的饱和蒸汽压与温度的关系,满足克劳休斯-克拉佩龙方程。[]6.25℃时H2(g)的标准摩尔燃烧焓等于25℃时H2O(g)的标准摩尔生成焓。[]7.对于反应2A(g)+1/2B(s)=Y(g)+3Z(s),rHm(T)=100kJ·mol-1,可以通过升温降压的方法使平衡最有效地向左移动。[]8.临界压力是气体在临界温度下液化所需的最低压力。[]9.在定温条件下,一个封闭体系经一过程对外所能作的最大功等于该过程亥姆霍茨函数的减少值。[]10.相同质量摩尔浓度的食盐水稀溶液和蔗糖稀溶液的沸点升高值相同。二、选择题[]1.在通常温度,NH4HCO3(s)可发生分解反应NH4HCO3(s)==NH3(g)+H2O(g)+CO2(g),现把1kg和20kgNH4HCO3(s)分别装入两个预先抽空的小型密闭容器A和B中,在一定温度下经平衡后,则(1)两容器中的压力相等;(2)A内的压力大于B内的压力;(3)B内的压力大于A内的压力;(4)须经实际测定后才能判定哪个容器内的压力大。[]2.对于只作膨胀功的封闭系统,()ATV的值是:(1)大于零;(2)小于零;(3)等于零;(4)不能确定。[]3.下列说法中不正确的是:(1)隔离系统中的熵永不减少;(2)封闭系统经绝热过程熵值不减少;(3)系统处于平衡态时熵达到最大值;(4)任何实际发生的热力学过程不可能出现[S(系统)+S(环境)]0。[]4.使气体致冷的节流膨胀,其焦耳—汤姆逊系数J-T必须(1)0;(2)0;(3)=0。[]5.B、C二组分溶液中,组分B的偏摩尔吉布斯函数,)()BC(,,BBCnpTnGG因此有:(1)GB与T,p,nC有关,与nB无关;(2)GB与T,p,nC,nB都有关;(3)GB与nB有关,与T,p,nC无关;(4)GB与nB,nC有关,与T,p无关。[]6.在温度为T时,纯液体组分A和B的饱和蒸气压分别为*Ap和*Bp,且*Bp=3*Ap,若组分A和B形成理想液态混合物,当气液两相平衡时,气相中组分A和B的物质的量相等。则组分A在液相中的摩尔分数应是(1)xA=0.5;(2)xA=3/4;(3)xA=1/4(4)xA=3/5。[]7.形成理想液态混合物过程的混合性质是:(1)mixH=0,mixS>0;(2)mixH<0,mixS=0;(3)mixH>0,mixS=0;(4)mixH=0,mixS<0。[]8.已知A,B两液体可组成无最高或最低恒沸点的液态完全互溶的系统,则将某一组成的溶液蒸馏可以获得:(1)一个纯组分和一个恒沸混合物;(2)两个恒沸混合物;(3)两个纯组分;(4)不确定。三、填空题1.A、B两组分混合物,用化学势表示气、液两相平衡条件是。2.在温度T时将NH4HS(s)置于抽空的容器中,当反应NH4HS(s)NH3(g)+H2S(g)达到平衡时,测得总压力为p,则反应的标准平衡常数K与总压力p的关系为。3.1mol理想气体由同一始态开始分别经可逆绝热膨胀(I)与不可逆绝热膨胀(II)至相同终态温度,则UIUII,SISII。(选填,=,)4.Na2CO3和H2O可组成的水合物有Na2CO3H2O(s)、Na2CO37H2O(s)、Na2CO310H2O(s)。在0.1MPa下与Na2CO3水溶液和冰平衡共存的水合物最多可有种。5.在25℃,O2和N2溶于水中的亨利系数分别为4.40106Pakgmol-1和8.68106Pakgmol-1,由亨利定律可知,在相同压力下,O2在水中的溶解度N2在水中的溶解度。(选择填“大于”“小于”或“等于”)6.在一绝热体积恒定的容器中,发生一个化学反应,使系统的温度从T1升高到T2,压力从p1升高到p2,则系统的U0,S0。(选择填“”“”或“=”)四、综合填空题1.1molC6H5CH3在其正常沸点(110.6℃)时的蒸发为101325Pa的蒸汽。已知在该温度下C6H5CH3的摩尔蒸发焓为33.38kJ·mol1,与蒸汽相比,液体的体积可以忽略不计,且蒸汽可视为理想气体。计算该过程的Q=;U=;G=。2.10mol理想气体,由25℃,1.0MPa膨胀到25℃,0.1MPa,该过程系统的熵变S=。3.C2H5OH(A)-H2O(B)所成的溶液中,xA=0.44。在323K时,总蒸汽压为24.8kPa,在气相中yA=0.57。已知该温度下纯水的蒸汽压pB*=12.3kPa。若以同温度同压力下的纯水为标准态,则该溶液中水活度因子为。4.0.17molH2(g)从1.43dm3,298K经绝热可逆膨胀到2.86dm3。H2(g)的Cp,m=28.8J·mol1·K1,按理想气体处理。计算终态温度T2=;该过程的U=;H=。5.25℃时,1molCH4(g)完全燃烧成H2O(g)和CO2(g)的标准反应焓变–806.3kJ·mol-1,水在25℃时的气化热为44.02kJ·mol-1,则CH4(g)在25℃时的标准摩尔燃烧焓cH(CH4,g,298K)=。6.液态汞的饱和蒸气压与温度T的关系式为473.22K/7024Pa)lHg,(ln*Tp,则25℃时Hg(l)的饱和蒸气压p*(Hg,l)=Pa,Hg(l)的摩尔蒸发焓vapHm=kJ·mol-1。7.A,B二组分凝聚系统为固态不互熔,液态完全互熔系统。熔点-组成图具有两个最低共熔点。一个为641K(wB=0.08),另一个为620K(wB=0.50)。在体系的熔点曲线上有一个最高点862K(wB=0.16)。A,B的熔点分别为924K和692K。(1)根据题意,画出A,B二组分的相图示意图。(2)在图上相应位置作出组成为wB=0.80的溶液的步冷曲线(800K—550K)。(3)将1kgwB=0.60的熔融体冷却到无限接近620K时,系统的平衡相有:(相态用l,s表示,成分用A、B、A+B表示),各相的量分别是kg和kg。五、证明题试证明:理想气体的定压热容Cp只是温度的函数,与压力p无关,即0TPpC。六、计算题1.某金属M的分解反应为M2O(s)=2M(s)+21O2(g),参与物的相关数据为M2O(s)M(s)O2(g)fHm(298.15K)/(kJmol-1)-31.000Sm(298.15K)/(JK-1mol-1)122.043.0205.0Cp,m/(JK-1mol-1)66.027.031.0试计算125℃时反应的标准摩尔焓变rHm,标准摩尔熵变rSm,及反应的标准平衡常数K。2.1molH2(g)与20molO2(g)的燃烧反应在一个绝热等容的氧弹中进行。已知反应H2(g)+12O2(g)→H2O(g)在298K下进行的标准摩尔反应焓变rH(298K)=242.67kJ·mol-1。氧气及水蒸气的定容摩尔热容分别为CV,m(O2,g)=27.2J·K-1·mol-1,CV,m(H2O,g)=31.38J·K-1·mol-1,且不随温度而变。试计算:(1)298K时上述反应的rU;(2)在氧弹内燃烧后产物的最高温度。(忽略氧弹的热容)参考答案一、是非题1.×2.√3.√4.×5.√6.×7.×8.√9.√10.×二、选择题1.①2.②3.③4.①5.②6.②7.①8.③三、填空题1.lBgBlAgA,2.2)(41ppK3.2121,SSUU4.1种5.6.0,0SU四、综合填空题1.Q=33.38kJ;U=30.17kJ;G=02.S=191.44J·K-13.1.554.T2=226K;U=-0.25kJ;H=-0.35kJ5.cH(CH4,g,298K)=-894.34kJ·mol-16.p*(Hg,l)=0.3337Pa,vapHm=58.398kJ·mol-17.①②③l(A+B),s(B);0.8kg,0.2kg五、证明题因为ppTHC)(pTTpTpTpHpTHpC)()()(因为理想气体0)(TpH,所以0)(TppC六、计算题1.1mrmolkJ0.31)K15.298(HT500600700800900100000.20.40.60.81Temp.(K)AwB→B时间p一定113mrmolkJ35.31molkJ}100662720.3121100.31{)K15.398(H11mrmolKJ5.66)K15.298(S1111mrmolKJ51.67molK}J298398ln662720.31215.66{)K15.398(S113mrmolkJ48.4molkJ)51.67398100.31()K15.398(GKRTGln)K15.398(mr2582.0K2.(1)1mrmrmolkJ4.24121RTHU(2)(298K)(T)U1U1U2(298K)U=U1+U2=0)298)(2.275.1938.31(104.241)298)]((5.19)(1[32,2,2TKTOmolCOHmolCUmVmVT=727.7K△V=0,△U=0H2O(g)+19.5O2H2+1/2O2+19.5O2H2O(g)+19.5O2



 三七文档所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。
三七文档所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。
本文标题:大连理工2004年物理化学(上)期末考试试卷A卷及答案
链接地址:https://www.777doc.com/doc-2554370 .html