当前位置:首页 > 行业资料 > 其它行业文档 > 2015《金太阳》化学二轮专题透析答案详解专题11
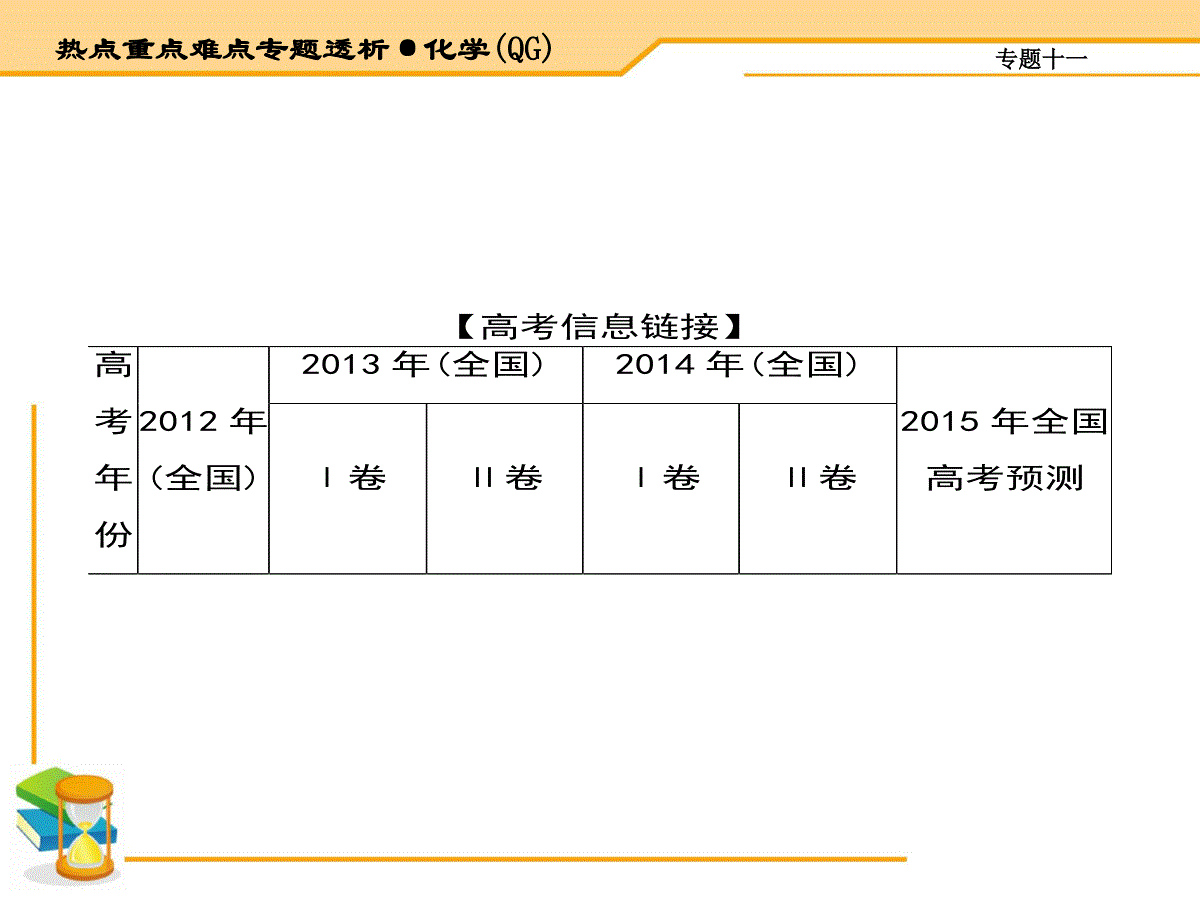
专题十一热点重点难点专题透析·化学(QG)专题十一热点重点难点专题透析·化学(QG)【高考信息链接】高考年份2012年(全国)2013年(全国)2014年(全国)2015年全国高考预测Ⅰ卷Ⅱ卷Ⅰ卷Ⅱ卷专题十一热点重点难点专题透析·化学(QG)题号分值26(14分)27(15分)27(14分)27(15分)27(15分)无机综合计算题考查的内容比较广泛,可以是无机化学中的任何知识(元素化合物、周期表、化学反应、化学实验、计算、电化学、电解质溶液、反应热等),很少涉及化学平衡知识,该内容常在原理综合题中出现。考查的形式可以是以元素化合物为情境,也可能是以化学工业流程题为命题形式考查内容计算、离子反应、氧化还原反应、原电池电极反应离子反应、氧化还原反应、原电池的电极反应离子反应、过滤洗涤、化学计算氧化还原反应、电离、水解、电解池的电极反应元素在周期表的位置、氧化还原反应、电解池中电极反应式的书写、化学计算专题十一热点重点难点专题透析·化学(QG)【知能在线诊断】1.(2014新课标全国理综Ⅰ·27)次磷酸(H3PO2)是一种精细磷化工产品,具有较强还原性,回答下列问题:(1)H3PO2是一元中强酸,写出其电离方程式:。(2)H3PO2及NaH2PO2均可将溶液中的Ag+还原为银,从而可用于化学镀银。①H3PO2中,P元素的化合价为。②利用H3PO2进行化学镀银反应中,氧化剂与还原剂的物质的量之比为4∶1,则氧化产物为(填化学式)。专题十一热点重点难点专题透析·化学(QG)③NaH2PO2为(填“正盐”或“酸式盐”),其溶液显(填“弱酸性”“中性”或“弱碱性”)。(3)H3PO2的工业制法是:将白磷(P4)与Ba(OH)2溶液反应生成PH3气体和Ba(H2PO2)2,后者再与H2SO4反应。写出白磷与Ba(OH)2溶液反应的化学方程式:。(4)H3PO2也可用电渗析法制备。“四室电渗析法”工作原理如下图所示(阳膜和阴膜分别只允许阳离子、阴离子通过):专题十一热点重点难点专题透析·化学(QG)①写出阳极的电极反应式:。②分析产品室可得到H3PO2的原因:。③早期采用“三室电渗析法”制备H3PO2:将“四室电渗析法”中阳极室的稀硫酸用H3PO2稀溶液代替。并撤去阳极室与产品室之间的阳膜,从而合并了阳极室与产品室。其缺点是产品中混有杂质。该杂质产生的原因是。【解析】由于H3PO2是中强酸,所以其电离方程式是H3PO2H++H2PO2-。(2)①根据化合物中正负化合价的代数和为0,H是+1价,O是-2价,所以在H3PO2中P元素的化合价专题十一热点重点难点专题透析·化学(QG)为+1价。②根据题意结合电子守恒、原子守恒可知,氧化产物为H3PO4,还原产物是Ag。③根据元素的化合价及电离情况可知H3PO2的结构是,所以NaH2PO2是正盐;由于该盐是强碱弱酸盐,所以该溶液显弱碱性。(3)根据题意可得白磷与氢氧化钡溶液反应的化学方程式是2P4+3Ba(OH)2+6H2O3Ba(H2PO2)2+2PH3↑;(4)①在阳极由于含有的阴离子OH-、SO42-、H2PO2-中放电能力最强的是OH-,所以发生反应:2H2O-4e-O2↑+4H+;②在产品室中,阳极室的H+穿过阳膜扩散至产品室,原料室的H2PO2-穿过阴膜扩散至产品室,二者反应生成H3PO2;③早期采用“三室电渗析法”制备H3PO2,将“四室电渗析法”中阳极室的稀硫酸用H3PO2稀专题十一热点重点难点专题透析·化学(QG)溶液代替,并撤去阳极室与产品室之间的阳膜,从而合并了阳极室与产品室,其缺点是阳极产生的氧气会把H3PO2或H2PO2-氧化为PO43-,使产品不纯。【答案】(1)H3PO2H++H2PO2-(2)①+1②H3PO4③正盐;弱碱性(3)2P4+3Ba(OH)2+6H2O3Ba(H2PO2)2+2PH3↑(4)①2H2O-4e-O2↑+4H+②阳极室的H+穿过阳膜扩散至产品室,原料室的H2PO2-穿过阴膜扩散至产品室,二者反应生成H3PO2专题十一热点重点难点专题透析·化学(QG)③PO43-;H3PO2或H2PO2-被氧化2.(2014天津理综·7)元素单质及其化合物有广泛用途,请根据周期表中第三周期元素相关知识回答下列问题:(1)按原子序数递增的顺序(稀有气体除外),以下说法正确的是。a.原子半径和离子半径均减小b.金属性减弱,非金属性增强c.氧化物对应的水化物碱性减弱,酸性增强d.单质的熔点降低(2)原子最外层电子数与次外层电子数相同的元素名称为,氧化性最弱的简单阳离子是。(3)已知:专题十一热点重点难点专题透析·化学(QG)化合物MgOAl2O3MgCl2AlCl3类型离子化合物离子化合物离子化合物共价化合物熔点/℃28002050714191工业制镁时,电解MgCl2而不电解MgO的原因是;专题十一热点重点难点专题透析·化学(QG)制铝时,电解Al2O3而不电解AlCl3的原因是。(4)晶体硅(熔点1410℃)是良好的半导体材料。由粗硅制纯硅过程如下:Si(粗)SiCl4SiCl4(纯)Si(纯)写出SiCl4的电子式:;在上述由SiCl4制纯硅的反应中,测得每生成1.12kg纯硅需吸收akJ热量,写出该反应的热化学方程式:。专题十一热点重点难点专题透析·化学(QG)(5)P2O5是非氧化性干燥剂,下列气体不能用浓硫酸干燥,可用P2O5干燥的是。a.NH3b.HIc.SO2d.CO2(6)KClO3可用于实验室制O2,若不加催化剂,400℃时分解只生成两种盐,其中一种是无氧酸盐,另一种盐的阴阳离子个数比为1∶1。写出该反应的化学方程式:。【解析】(1)a.原子序数递增,离子半径也可能增大,错误;b.第三周期元素随原子序数的递增,金属性减弱,非金属性增强,正确;c.没有指明为最高价氧化物,错误;d.单质的熔点也可能增大,错误。(2)第三周期原子最外层电子数与次外层电子数相同的元素是氩,都是8;氧化性最弱的简单专题十一热点重点难点专题透析·化学(QG)阳离子是Na+。(3)MgO的熔点远远大于MgCl2的熔点,熔融时耗费更多能源,增加生产成本;AgCl3是共价化合物,熔融态难导电,所以不能电解熔融AlCl3。(4)SiCl4中Si分别与Cl形成1对共用电子,所以电子式为··Cl······Si······Cl········Cl······Cl····,生成1.12kg纯硅需吸收akJ热量,则生成28g纯硅需吸收0.025akJ,可得热化学方程式。(5)NH3既不能用浓硫酸干燥,也不能用P2O5干燥,HI不能用浓硫酸干燥,可用P2PO5干燥,SO2能用浓硫酸干燥,CO2能用浓硫酸干燥,所以b项正专题十一热点重点难点专题透析·化学(QG)确。(6)一种是无氧酸盐,另一种盐的阴阳离子个数比为1∶1,根据氧化还原反应的原理,这两种盐分别为KCl、KClO4,配平可得化学方程式。【答案】(1)b(2)氩;Na+(或钠离子)(3)MgO的熔点高,熔融时耗费更多能源,增加生产成本;AlCl3是共价化合物,熔融态难导电专题十一热点重点难点专题透析·化学(QG)(4)··Cl······Si······Cl········Cl······Cl····;SiCl4(g)+2H2(g)Si(s)+4HCl(g)ΔH=+0.025akJ·mol-1(5)b(6)4KClO3KCl+3KClO43.(2014新课标全国理综Ⅱ·27)铅及其化合物可用于蓄电池、耐酸设备及X射线防护材料等。回答下列问题:专题十一热点重点难点专题透析·化学(QG)(1)铅是碳的同族元素,比碳多4个电子层。铅在元素周期表的位置为第周期、第族;PbO2的酸性比CO2的酸性(填“强”或“弱”)。(2)PbO2与浓盐酸共热生成黄绿色气体,反应的化学方程式为。(3)PbO2可由PbO与次氯酸钠溶液反应制得,反应的离子方程式为;PbO2也可以通过石墨为电极,Pb(NO3)2和Cu(NO3)2的混合溶液为电解液电解制取。阳极发生的电极反应式为,阴极上观察到的现象是;若电解液中不加入Cu(NO3)2,阴极发专题十一热点重点难点专题透析·化学(QG)生的电极反应式为,这样做的主要缺点是。(4)PbO2在加热过程发生分解的失重曲线如下图所示,已知失重曲线上的a点为样品失重4.0%(即样品起始质量-a点固体质量样品起始质量×100%)的残留固体。若a点固体组成表示为PbOx或mPbO2·nPbO,列式计算x值和m∶n值。专题十一热点重点难点专题透析·化学(QG)【解析】(1)碳在元素周期表中位于第二周期ⅣA族,铅是碳的同族元素,比碳多4个电子层,故铅在元素周期表的位置为第六周期ⅣA族;铅位于碳的下方,同主族元素由上到下,非金属性逐渐减弱,故PbO2的酸性比CO2的酸性弱。(2)PbO2中的Pb为+4价,Pb为+2价时相对稳定,故PbO2中的Pb具有强氧化性,能发生类似MnO2与浓盐酸的反应,将Cl-氧化为Cl2,故反应的化学方程式为PbO2+4HCl(浓)PbCl2+Cl2↑+2H2O。(3)由PbO和NaClO反应制PbO2,PbO→PbO2,Pb的化合价升高,则NaClO作氧化剂,本身被还原为NaCl,故离子方程式为PbO+ClO-PbO2+Cl-;石墨为电极,电解Pb(NO3)2和Cu(NO3)2的混合液制PbO2,则Pb2+应在阳极发生氧化反应得到PbO2,故阳极电极反应式为Pb2++2H2O-2e-PbO2↓+4H+;阴极上阳离子反应,阳离子有Pb2+、Cu2+、H+,根专题十一热点重点难点专题透析·化学(QG)据阳离子放电顺序,应为Cu2++2e-Cu↓,而生成的金属Cu会覆在石墨电极上,故阴极观察到的现象为石墨上包上铜镀层;若电解液中不加入Cu(NO3)2,阴极Pb2+放电,生成金属Pb,Pb2++2e-Pb↓,这样Pb2+被消耗不能生成PbO2,降低了Pb2+的利用率。(4)根据PbO2PbOx+2-𝑥2O2↑(注PbO2相对分子质量为239),由2-𝑥2×32=239×4.0%,得x=2-239×4.0%16≈1.4;根据mPbO2·nPbO,得2𝑚+𝑛𝑚+𝑛=1.4,𝑚𝑛=0.40.6=23。【答案】(1)六;ⅣA;弱(2)PbO2+4HCl(浓)PbCl2+Cl2↑+2H2O专题十一热点重点难点专题透析·化学(QG)(3)PbO+ClO-PbO2+Cl-;Pb2++2H2O-2e-PbO2↓+4H+;石墨上包上铜镀层;Pb2++2e-Pb↓;不能有效利用Pb2+(4)根据PbO2PbOx+2-𝑥2O2↑,有2-𝑥2×32=239×4.0%,x=2-239×4.0%16=1.4根据mPbO2·nPbO,2𝑚+𝑛𝑚+𝑛=1.4,𝑚𝑛=0.40.6=234.(2014四川理综·11)污染物的有效去除和资源的充分利用是化学造福人类的重要研究课题。某研究小组利用软锰矿(主要成分为MnO2,另含有少量铁、铝、铜、镍等金属化合物)作脱硫剂,通过如下简化流程既脱除燃煤尾气中的SO2,又制得电池材料MnO2(反应条件已省略)。专题十一热点重点难点专题透析·化学(QG)请回答下列问题:(1)上述流程脱硫实现了(选填下列字母编号)。A.废弃物的综合利用B.白色污染的减少C.酸雨的减少(2)用MnCO3能除去溶液中Al3+和Fe3+,其原因是。专题十一热点重点难点专题透析·化学(QG)(3)已知:25℃、101kPa时,Mn(s)+O2(g)MnO2(s)ΔH=-520kJ·mol-1S(s)+O2(g)SO2(g)ΔH=-297kJ·mol-1Mn(s)+S(s)+2O2(g)MnSO4(s)ΔH=-1065kJ·mol-1SO2与MnO2反应生成无水MnSO4的热化学方程式是。(4)MnO2可作超级电容器材料。用惰性电极电解MnSO4溶液可制得MnO2,其阳极的电极反应式是。专题十一热点重点难点专题透析·化学(QG)(5)MnO2是碱性锌锰电池的正极材料。碱性锌锰电池放电时,正极的电极反应



 三七文档所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。
三七文档所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。
本文标题:2015《金太阳》化学二轮专题透析答案详解专题11
链接地址:https://www.777doc.com/doc-3017474 .html