当前位置:首页 > 商业/管理/HR > 其它文档 > 高三化学复习化学反应原理大题专项练习
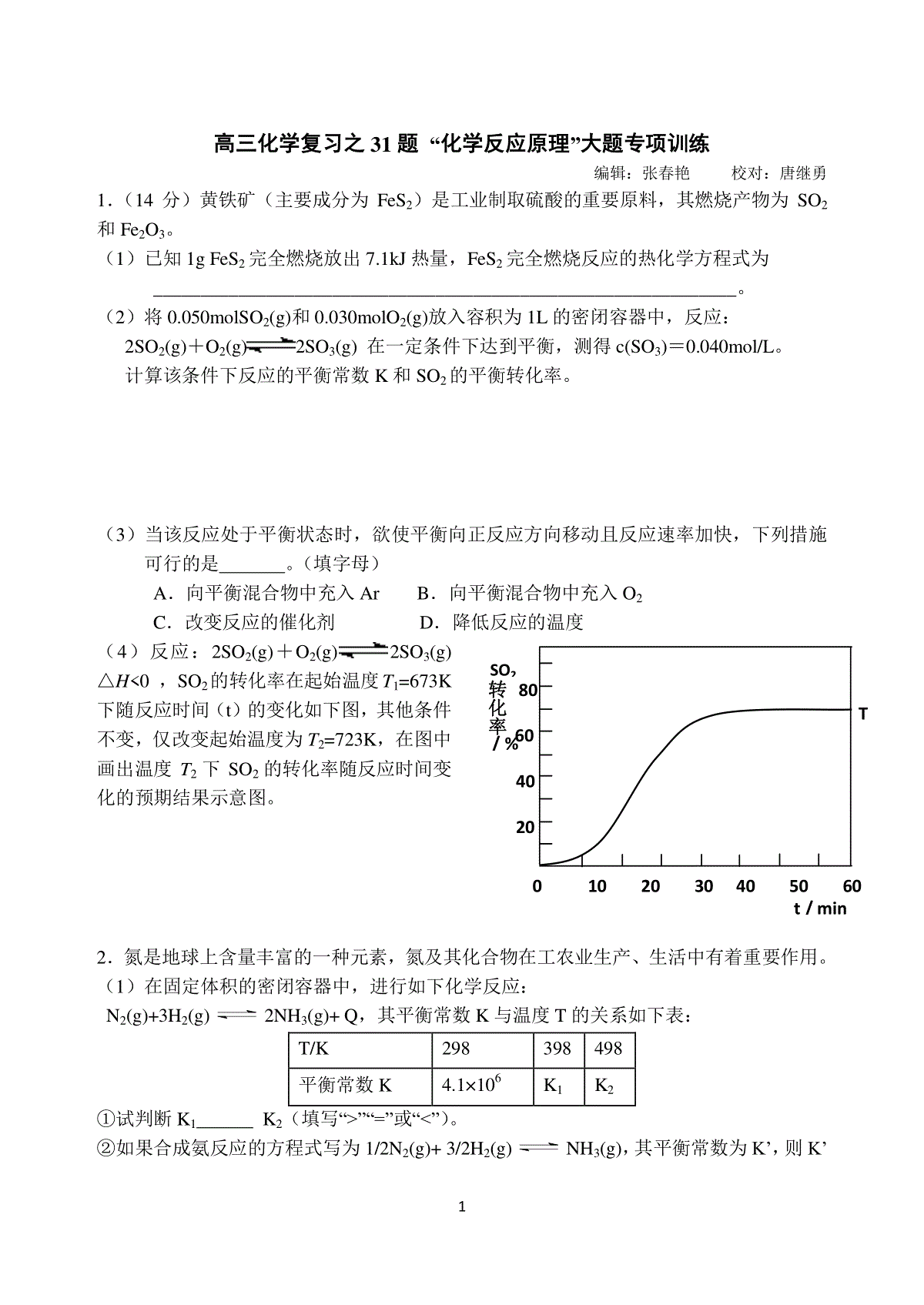
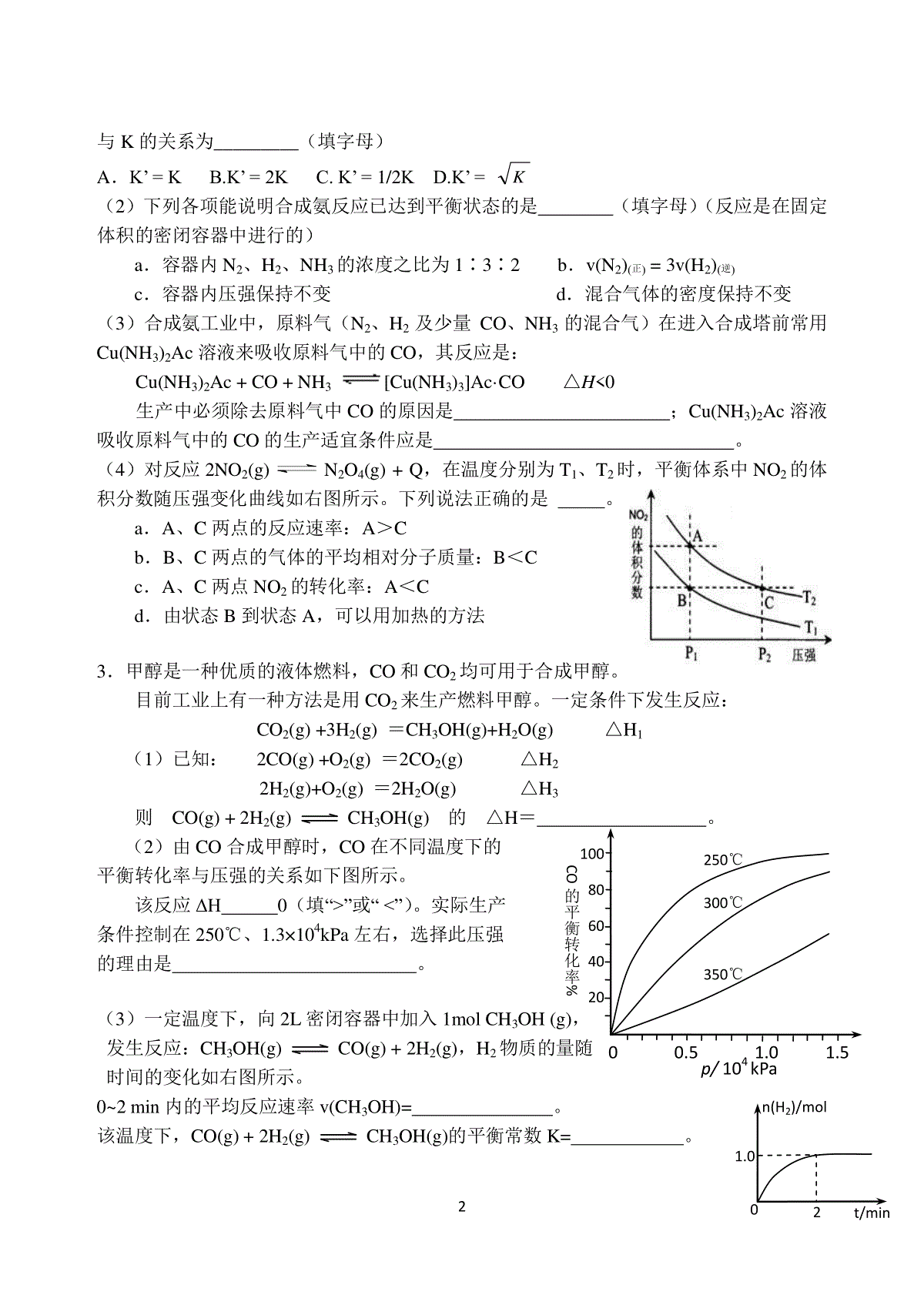
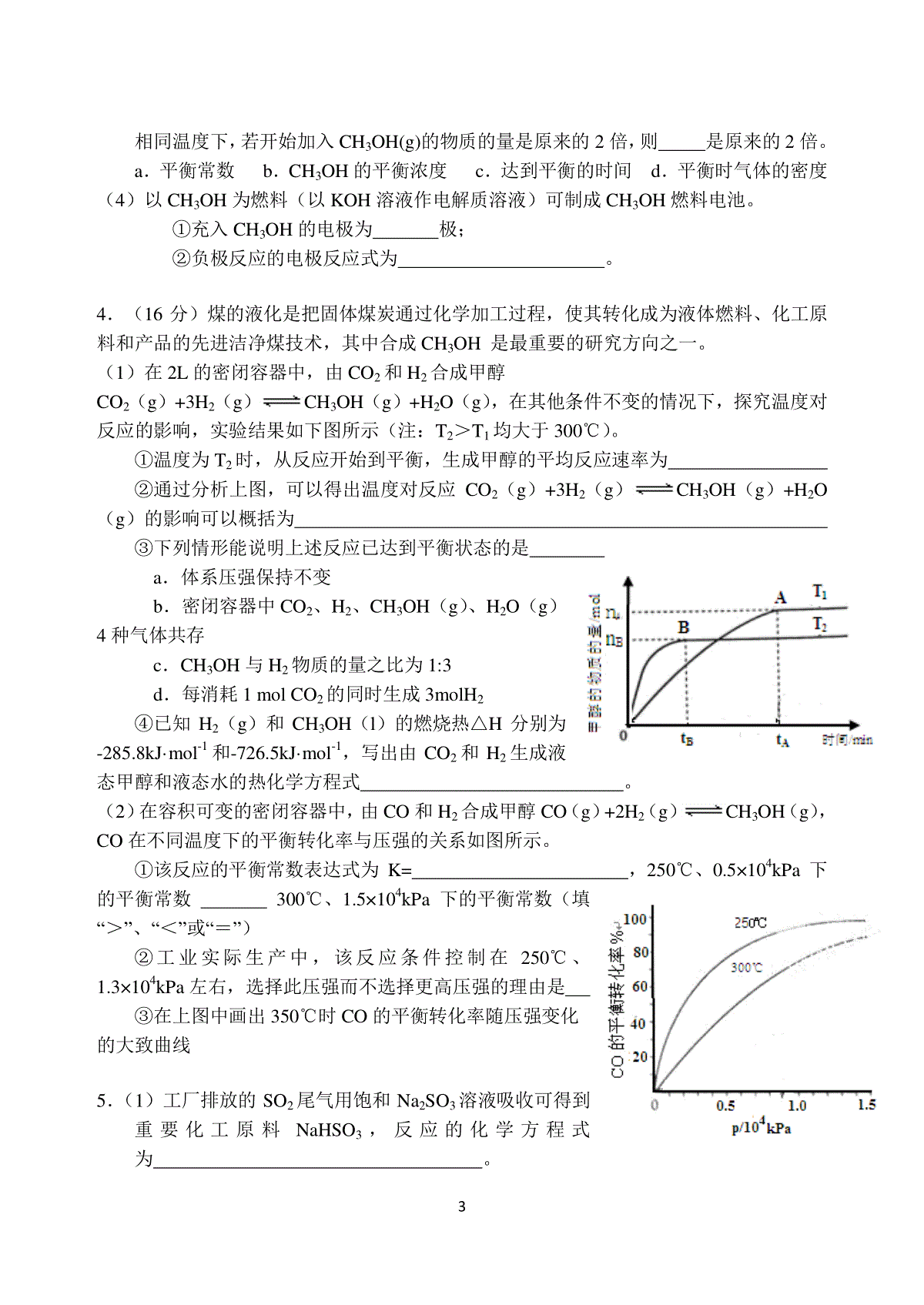
1高三化学复习之31题“化学反应原理”大题专项训练编辑:张春艳校对:唐继勇1.(14分)黄铁矿(主要成分为FeS2)是工业制取硫酸的重要原料,其燃烧产物为SO2和Fe2O3。(1)已知1gFeS2完全燃烧放出7.1kJ热量,FeS2完全燃烧反应的热化学方程式为______________________________________________________________。(2)将0.050molSO2(g)和0.030molO2(g)放入容积为1L的密闭容器中,反应:2SO2(g)+O2(g)2SO3(g)在一定条件下达到平衡,测得c(SO3)=0.040mol/L。计算该条件下反应的平衡常数K和SO2的平衡转化率。(3)当该反应处于平衡状态时,欲使平衡向正反应方向移动且反应速率加快,下列措施可行的是。(填字母)A.向平衡混合物中充入ArB.向平衡混合物中充入O2C.改变反应的催化剂D.降低反应的温度(4)反应:2SO2(g)+O2(g)2SO3(g)△H0,SO2的转化率在起始温度T1=673K下随反应时间(t)的变化如下图,其他条件不变,仅改变起始温度为T2=723K,在图中画出温度T2下SO2的转化率随反应时间变化的预期结果示意图。2.氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。(1)在固定体积的密闭容器中,进行如下化学反应:N2(g)+3H2(g)2NH3(g)+Q,其平衡常数K与温度T的关系如下表:T/K298398498平衡常数K4.1×106K1K2①试判断K1K2(填写“”“=”或“”)。②如果合成氨反应的方程式写为1/2N2(g)+3/2H2(g)NH3(g),其平衡常数为K’,则K’010203040506070t/min转化率SO2/%20806040T1200.51.01.510080604020CO的平衡转化率%p/104kPa250℃300℃350℃n(H2)/molt/min1.020与K的关系为_________(填字母)A.K’=KB.K’=2KC.K’=1/2KD.K’=K(2)下列各项能说明合成氨反应已达到平衡状态的是(填字母)(反应是在固定体积的密闭容器中进行的)a.容器内N2、H2、NH3的浓度之比为1∶3∶2b.v(N2)(正)=3v(H2)(逆)c.容器内压强保持不变d.混合气体的密度保持不变(3)合成氨工业中,原料气(N2、H2及少量CO、NH3的混合气)在进入合成塔前常用Cu(NH3)2Ac溶液来吸收原料气中的CO,其反应是:Cu(NH3)2Ac+CO+NH3[Cu(NH3)3]Ac·CO△H0生产中必须除去原料气中CO的原因是;Cu(NH3)2Ac溶液吸收原料气中的CO的生产适宜条件应是。(4)对反应2NO2(g)N2O4(g)+Q,在温度分别为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如右图所示。下列说法正确的是。a.A、C两点的反应速率:A>Cb.B、C两点的气体的平均相对分子质量:B<Cc.A、C两点NO2的转化率:A<Cd.由状态B到状态A,可以用加热的方法3.甲醇是一种优质的液体燃料,CO和CO2均可用于合成甲醇。目前工业上有一种方法是用CO2来生产燃料甲醇。一定条件下发生反应:CO2(g)+3H2(g)=CH3OH(g)+H2O(g)△H1(1)已知:2CO(g)+O2(g)=2CO2(g)△H22H2(g)+O2(g)=2H2O(g)△H3则CO(g)+2H2(g)CH3OH(g)的△H=。(2)由CO合成甲醇时,CO在不同温度下的平衡转化率与压强的关系如下图所示。该反应ΔH0(填“”或“”)。实际生产条件控制在250℃、1.3×104kPa左右,选择此压强的理由是。(3)一定温度下,向2L密闭容器中加入1molCH3OH(g),发生反应:CH3OH(g)CO(g)+2H2(g),H2物质的量随时间的变化如右图所示。0~2min内的平均反应速率v(CH3OH)=。该温度下,CO(g)+2H2(g)CH3OH(g)的平衡常数K=。3相同温度下,若开始加入CH3OH(g)的物质的量是原来的2倍,则是原来的2倍。a.平衡常数b.CH3OH的平衡浓度c.达到平衡的时间d.平衡时气体的密度(4)以CH3OH为燃料(以KOH溶液作电解质溶液)可制成CH3OH燃料电池。①充入CH3OH的电极为极;②负极反应的电极反应式为。4.(16分)煤的液化是把固体煤炭通过化学加工过程,使其转化成为液体燃料、化工原料和产品的先进洁净煤技术,其中合成CH3OH是最重要的研究方向之一。(1)在2L的密闭容器中,由CO2和H2合成甲醇CO2(g)+3H2(g)CH3OH(g)+H2O(g),在其他条件不变的情况下,探究温度对反应的影响,实验结果如下图所示(注:T2>T1均大于300℃)。①温度为T2时,从反应开始到平衡,生成甲醇的平均反应速率为②通过分析上图,可以得出温度对反应CO2(g)+3H2(g)CH3OH(g)+H2O(g)的影响可以概括为③下列情形能说明上述反应已达到平衡状态的是a.体系压强保持不变b.密闭容器中CO2、H2、CH3OH(g)、H2O(g)4种气体共存c.CH3OH与H2物质的量之比为1:3d.每消耗1molCO2的同时生成3molH2④已知H2(g)和CH3OH(l)的燃烧热△H分别为-285.8kJ·mol-1和-726.5kJ·mol-1,写出由CO2和H2生成液态甲醇和液态水的热化学方程式。(2)在容积可变的密闭容器中,由CO和H2合成甲醇CO(g)+2H2(g)CH3OH(g),CO在不同温度下的平衡转化率与压强的关系如图所示。①该反应的平衡常数表达式为K=,250℃、0.5×104kPa下的平衡常数300℃、1.5×104kPa下的平衡常数(填“>”、“<”或“=”)②工业实际生产中,该反应条件控制在250℃、1.3×104kPa左右,选择此压强而不选择更高压强的理由是③在上图中画出350℃时CO的平衡转化率随压强变化的大致曲线5.(1)工厂排放的SO2尾气用饱和Na2SO3溶液吸收可得到重要化工原料NaHSO3,反应的化学方程式为。4(2)合成氨的反应N2(g)+3H2(g)2NH3(g)△H=-92.4kJ·mol-1,在一定条件下的密闭容器中该反应已达到平衡,要再提高N2的转化率,可以采取的措施是_________(填字母代号)。a.升高温度b.加入催化剂c.增加H2的浓度d.增加N2的浓度e.分离出NH3(3)碘不易溶于水,但易溶于碘化钾溶液并生成含碘离子(aq表示水合状态)I2(aq)+I-(aq)I3-(aq)……①I2(aq)+2I-(aq)I42-(aq)……②则反应②的平衡常数表达式,。(4)日本核泄漏中最危险的是131I,它能引发甲状腺癌。但127I却是人体必需的。下列有关碘的描述中,正确的是。A.12653I、12753I、12853I、13153I、是四种相同的核素B.已知131I的半衰期很短,所以浓度极低时不会对公众健康构成危害C.127I可阻隔甲状腺吸收放射性131I。已知碘盐含127I为30mg·kg-1,成人一次摄入碘盐约3kg才有预防效果。所以,日用碘盐对预防碘辐射起不到有效作用D.碘片含127I为100mg/片,一片能阻断90%放射性碘在甲状腺内沉积,按医嘱服用碘片可防止131I的辐射(5)在25℃下,向浓度均为0.1mol·L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成__________沉淀(填化学式),生成该沉淀的离子方程式为____________。已知25℃时Ksp[Mg(OH)2]=1.8×10-11,Ksp[Cu(OH)2]=2.2×10-20。[来源:学+科+网]6.(16分)工业上用CO生产燃料甲醇。一定条件下发生反应:CO(g)+2H2(g)CH3OH(g)。图1表示反应中能量的变化;图2表示一定温度下,在体积为2L的密闭容器中加入4molH2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化。请回答下列问题:(1)在“图1”中,曲线(填:a或b)表示使用了催化剂;该反应属于(填:吸热、放热)反应。(2)下列说法正确的是A.起始充入的CO为2mol5B.增加CO浓度,CO的转化率增大C.容器中压强恒定时,反应已达平衡状态D.保持温度和密闭容器容积不变,再充入1molCO和2molH2,再次达到平衡时n(CH3OH)/n(CO)会减小(3)从反应开始到建立平衡,v(H2)=________;该温度下CO(g)+2H2(g)CH3OH(g)的化学平衡常数为______________。若保持其它条件不变,将反应体系升温,则该反应化学平衡常数____(填“增大”、“减小”或“不变”)。(4)请在“图3”中画出平衡时甲醇百分含量(纵坐标)随温度(横坐标)变化的曲线,要求画压强不同的2条曲线(在曲线上标出P1、P2,且P1P2)。(5)已知CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(g)ΔH=-192.9kJ/mol又知H2O(l)=H2O(g)ΔH=+44kJ/mol,请写出32g的CH3OH(g)完全燃烧生成液态水的热化学方程式。7.(12分)汽车尾气里含有NO气体是由于内燃机燃烧的高温引起氮气和氧气反应所致:N2(g)+O2(g)2NO(g)△H0已知该反应在2404℃时,平衡常数K=64×10-4。请回答:(1)该反应的平衡常数表达式为。(2)该温度下,向2L密闭容器中充入N2和O2各1mol,平衡时,N2的转化率是%(保留整数)。(3)该温度下,某时刻测得容器内N2、O2、NO的浓度分别为2.5×10-1mol/L、4.0×10-2mol/L和3.0×10-3mol/L,此时反应(填“处于化学平衡状态”、“向正反应方向进行”或“向逆反应方向进行”),理由是。(4)将N2、O2的混合气体充入恒温恒容密闭容器中,下列变化趋势正确的是(填字母序号)。(5)向恒温恒容的密闭容器中充入等物质的量的N2和O2,达到平衡状态后再向其中充入一定量NO,重新达到化学平衡状态。与原平衡状态相比,此时平衡混合气中NO的体积分数(填“变大、“变小”或“不变”)。8.(16分)在汽车上安装三效催化转化器,可使汽车尾气中的主要污染物(CO、NOx、碳氢化合物)进行相互反应,生成无毒物质,减少汽车尾气污染。6(1)已知:N2(g)+O2(g)=2NO(g)△H=+180.5kJ/mol2C(s)+O2(g)=2CO(g)△H=-221.0kJ/molC(s)+O2(g)=CO2(g)△H=-393.5kJ/mol尾气转化的反应之一:2NO(g)+2CO(g)=N2(g)+2CO2(g)△H=。(2)某研究性学习小组在技术人员的指导下,在某温度时,按下列流程探究某种催化剂作用下的反应速率,用气体传感器测得不同时间的NO和CO浓度如表:汽车尾气尾气分析仪催化反应器尾气分析仪时间/S012345C(NO)(×10-4mol.L-1)10.04.052.501.501.001.00C(CO)(×10-3mol.L-1)3.603.052.852.752.702.70请回答下列问题(均不考虑温度变化对催化剂催化效率的影响):①前2s内的平均反应速率v(N2)=___________________。②在该温度下,反应的平衡常数K=。(只写出计算结果)③对于该可逆反应,通过综合分析以上信息,至少..可以说明(填字母)。A.该反应的反应物混合后很不稳定B.该反应一旦发生将在很短的时间内完成C.该反应体系达到平衡时至少有一种反应物的百分含量较小D.该反应在一定条件下能自发进行E.该反应使用催化剂意义不大(3)CO分析仪以燃料电池为工作原理,其装置如图所示,该电池中电解质为氧化钇-氧化钠,其中O2-可以在固体介质NASICON中自由移动。下列说法错误的是。A.负极的电极反应式为:CO+O2—―2e-=CO2B.工作时电极b作正


 三七文档所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。
三七文档所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。
本文标题:高三化学复习化学反应原理大题专项练习
链接地址:https://www.777doc.com/doc-4126189 .html