当前位置:首页 > 中学教育 > 高中教育 > 2011年全国统一高考化学试卷(新课标卷)答案与解析
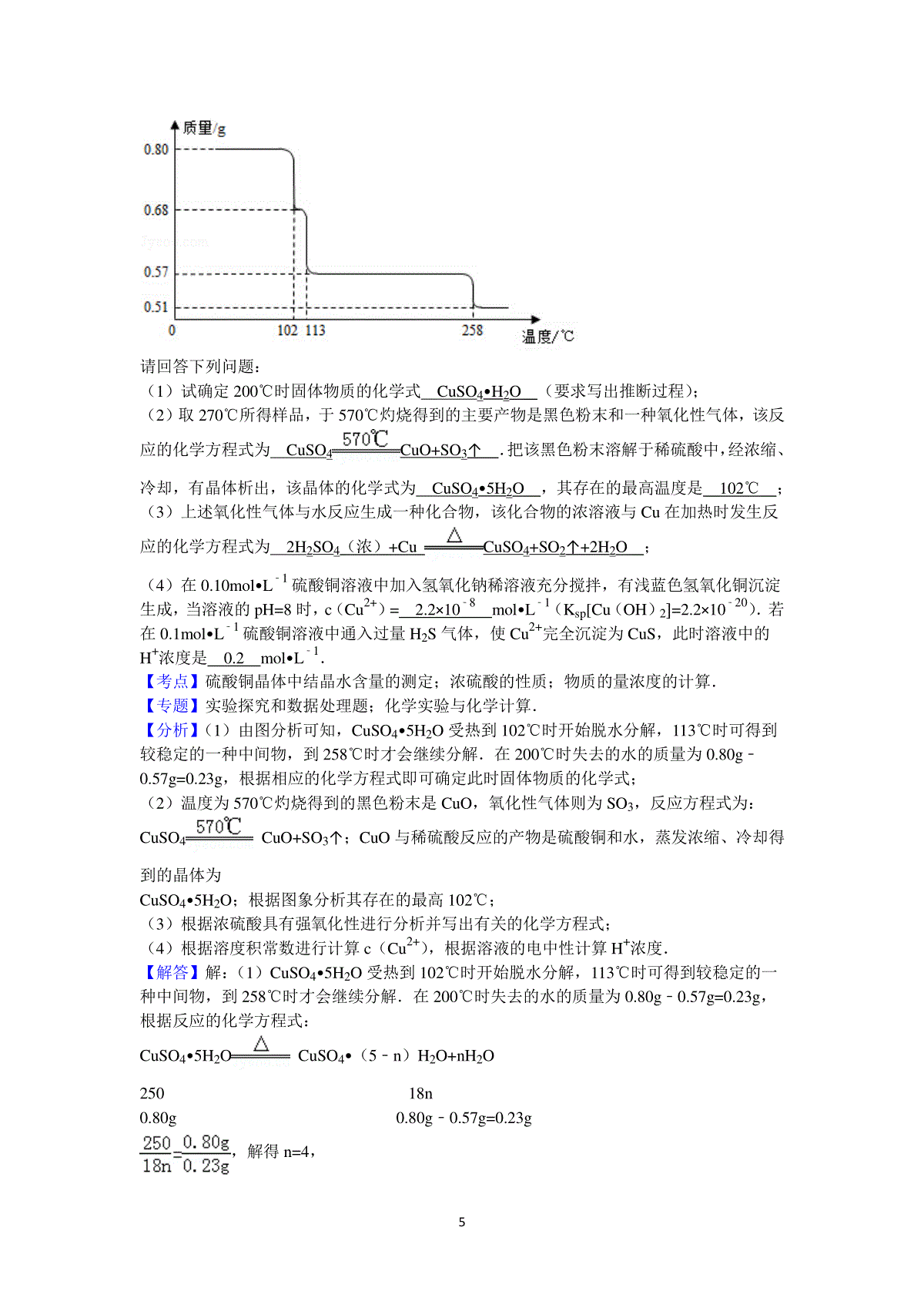
12011年全国统一高考化学试卷(新课标卷)参考答案与试题解析一、选择题1.下列叙述正确的是()A.1.00molNaCl中含有6.02×1023个NaCl分子B.1.00molNaCl中,所有Na+的最外层电子总数为8×6.02×1023C.欲配置1.00L,1.00mol.L﹣1的NaCl溶液,可将58.5gNaCl溶于1.00L水中D.电解58.5g熔融的NaCl,能产生22.4L氯气(标准状况)、23.0g金属钠【考点】物质的量的相关计算;物质的量浓度的相关计算.菁优网版权所有【分析】根据物质的构成、离子的电子排布来分析微粒的物质的量,并根据溶液的配制来分析溶液的体积,利用电解反应中氯化钠的物质的量来计算电解产物的量即可解答.【解答】解:A、因NaCl为离子化合物,则不存在NaCl分子,故A错误;B、因Na+的最外层电子总数为8电子稳定结构,则最外层电子的物质的量为8mol,其电子总数为8×6.02×1023,故B正确;C、欲配置1.00L,1.00mol.L﹣1的NaCl溶液,可将58.5gNaCl溶于适量水中,配成1L溶液,而不是溶于1L的水中,故C错误;D、NaCl的物质的量为=1mol,则电解58.5g熔融的NaCl,1molNaCl生成0.5mol氯气,能产生0.5mol×22.4L/mol=11.2L氯气(标准状况),而不是22.4L氯气,故D错误;故选:B.【点评】本题考查微观粒子的物质的量的计算,明确物质的构成、电子排布、溶液的配制,电解等知识点来解答,学生熟悉物质的量的计算、利用原子守恒来判断电解产物的物质的量是解答本题的关键.2.分子式为C5H11Cl的同分异构体共有(不考虑立体异构)()A.6种B.7种C.8种D.9种【考点】同分异构现象和同分异构体.菁优网版权所有【专题】同分异构体的类型及其判定.【分析】判断和书写烷烃的氯代物的异构体可以按照以下步骤来做:(1)先确定烷烃的碳链异构,即烷烃的同分异构体.(2)确定烷烃的对称中心,即找出等效的氢原子.(3)根据先中心后外围的原则,将氯原子逐一去代替氢原子.(4)对于多氯代烷的同分异构体,遵循先集中后分散的原则,先将几个氯原子集中取代同一碳原子上的氢,后分散去取代不同碳原子上的氢.【解答】解:分子式为C5H11Cl的同分异构体有主链有5个碳原子的:CH3CH2CH2CH2CH2Cl;CH3CH2CH2CHClCH3;CH3CH2CHClCH2CH3;主链有4个碳原子的:CH3CH(CH3)CH2CH2Cl;CH3CH(CH3)CHClCH3;CH3CCl(CH3)CH2CH3;CH2ClCH(CH3)CH2CH3;主链有3个碳原子的:CH2C(CH3)2CH2Cl;共有8种情况.故选C.【点评】本题考查以氯代物的同分异构体的判断,难度不大,做题时要抓住判断角度,找出等效氢原子种类.一般说来,同一个碳原子上的氢原子等效,同一个碳原子上连的所有甲基2上的氢原子等效,处于镜面对称位置上的氢原子等效.氯原子取代任意一个等效氢原子所得的一氯代物是同一种.只要这样就可以了.比如说丙烷有两种一氯代物.3.下列反应中,属于取代反应的是()①CH3CH=CH2+Br2CH3CHBrCH2Br②CH3CH2OHCH2=CH2+H2O③CH3COOH+CH3CH2OHCH3COOCH2CH3+H2O④C6H6+HNO3C6H5NO2+H2O.A.①②B.③④C.①③D.②④【考点】取代反应与加成反应.菁优网版权所有【分析】①烯烃具有双键,与溴的反应属于加成反应;②在浓硫酸作用下,加热到1700C时,乙醇发生消去反应,生成乙烯和水;③乙酸和乙醇在浓硫酸作用下加热时发生酯化反应,生成乙酸乙酯和水,也属于取代反应;④在浓硫酸作用下,加热时苯和浓硝酸发生硝化反应生成硝基苯和水,也属于取代反应.【解答】解:A、①属于加成反应;②属于消去反应,故A错;B、③属于酯化反应,也属于取代反应;④属于苯的硝化反应,也属于取代反应,故B正确;C、①属于加成反应;③属于酯化反应,也属于取代反应,故C错;D、②属于消去反应;④属于苯的硝化反应,也属于取代反应,故D错.故选B.【点评】本题考查有机物的反应类型,做题时注意有机物的化学性质.4.将浓度为0.1mol•L﹣1HF溶液加水不断稀释,下列各量始终保持增大的是()A.c(H+)B.Ka(HF)C.D.【考点】弱电解质在水溶液中的电离平衡.菁优网版权所有【专题】热点问题;类比迁移思想;控制单因变量法;电离平衡与溶液的pH专题.【分析】根据HF属于弱电解质,则在加水不断稀释时,电离程度增大,电离平衡保持向正反应方向移动,并注意温度不变时,电离平衡常数不变来解答.【解答】解:A、因HF为弱酸,则浓度为0.1mol•L﹣1HF溶液加水不断稀释,促进电离,平衡正向移动,电离程度增大,n(H+)增大,但c(H+)不断减小,故A错误;B、因电离平衡常数只与温度有关,则Ka(HF)在稀释过程中不变,故B错误;C、因稀释时一段时间电离产生等量的H+和F﹣,溶液的体积相同,则两种离子的浓度的比值不变,但随着稀释的不断进行,c(H+)不会超过10﹣7mol•L﹣1,c(F﹣)不断减小,则比值变小,故C错误;3D、因Ka(HF)=,当HF溶液加水不断稀释,促进电离,c(F﹣)不断减小,Ka(HF)不变,则增大,故D正确;故选:D.【点评】本题考查弱电解质的稀释,明确稀释中电离程度、离子浓度、Ka的变化即可解答,本题难点和易错点是不断稀释时c(H+)不会超过10﹣7mol•L﹣1.5.铁镍蓄电池又称爱迪生电池,放电时的总反应为:Fe+Ni2O3+3H2O=Fe(OH)2+2Ni(OH)2,下列有关该电池的说法不正确的是()A.电池的电解液为碱性溶液,正极为Ni2O3、负极为FeB.电池放电时,负极反应为Fe+2OH﹣﹣2e﹣=Fe(OH)2C.电池充电过程中,阴极附近溶液的pH降低D.电池充电时,阳极反应为2Ni(OH)2+2OH﹣﹣2e﹣=Ni2O3+3H2O【考点】原电池和电解池的工作原理;电极反应和电池反应方程式.菁优网版权所有【分析】根据电池的总反应:Fe+Ni2O3+3H2O=Fe(OH)2+2Ni(OH)2,可以判断出铁镍蓄电池放电时Fe作负极,发生氧化反应,为还原剂,失电子生成Fe2+,最终生成Fe(OH)2,Ni2O3作正极,发生还原反应,为氧化剂,得电子,最终生成Ni(OH)2,电池放电时,负极反应为Fe+2OH﹣﹣2e﹣=Fe(OH)2,则充电时,阴极发生Fe(OH)2+2e﹣=Fe+2OH﹣,阴极附近溶液的pH升高,电池充电时,阳极发生2Ni(OH)2+2OH﹣﹣2e﹣=Ni2O3+3H2O.【解答】解:A、反应后产物有氢氧化物,可得电解液为碱性溶液,由放电时的反应可以得出铁做还原剂失去电子,Ni2O3做氧化剂得到电子,即正极为Ni2O3、负极为Fe,故A正确;B、根据总反应Fe+Ni2O3+3H2O=Fe(OH)2+2Ni(OH)2,可以判断出铁镍蓄电池放电时Fe作负极,发生氧化反应,为还原剂,失电子生成Fe2+,碱性电解质中最终生成Fe(OH)2,负极反应为:Fe+2OH﹣﹣2e﹣=Fe(OH)2,故B正确;C、充电可以看作是放电的逆过程,即阴极为原来的负极,所以电池放电时,负极反应为:Fe+2OH﹣﹣2e﹣=Fe(OH)2,所以电池充电过程时阴极反应为Fe(OH)2+2e﹣=Fe+2OH﹣,因此电池充电过程中阴极附近溶液的pH会升高,故C错误;D、充电时,阴极发生Fe(OH)2+2e﹣=Fe+2OH﹣,阳极发生2Ni(OH)2+2OH﹣﹣2e﹣=Ni2O3+3H2O,故D正确.故选C.【点评】本题考查二次电池的工作原理,涉及到原电池和电解池的有关知识,做题时注意根据总反应从氧化还原的角度判断化合价的变化,以得出电池的正负极以及所发生的反应.6.能正确表示下列反应的离子方程式为()A.硫化亚铁溶于稀硝酸中:FeS+2H+=Fe2++H2S↑B.NH4HCO3溶于过量的NaOH溶液中:HCO3﹣+OH﹣=CO32﹣+H2OC.少量SO2通入苯酚钠溶液中:C6H5O﹣+SO2+H2O=C6H5OH+HSO3﹣D.大理石溶于醋酸中:CaCO3+2CH3COOH=Ca2++2CH3COO﹣+CO2↑+H2O【考点】离子方程式的书写.菁优网版权所有【专题】压轴题;离子反应专题.【分析】A.硝酸具有强氧化性,能氧化FeS;4B.漏写铵根离子与氢氧根离子的反应;C.少量SO2通入苯酚钠溶液生成亚硫酸根离子;D.碳酸钙和醋酸反应生成醋酸钙、水和二氧化碳.【解答】解:A.硝酸具有氧化性,能氧化FeS,因此产物应该是硝酸铁、硫酸和一氧化氮,故A错误;B.NH4HCO3溶于过量的NaOH溶液中除了生成碳酸钠外还有一水合氨生成,方程式为NH4++HCO3﹣+2OH﹣=CO32﹣+H2O+NH3.H2O,故B错误;C.SO2不足产物应该是SO32﹣,少量SO2通入苯酚钠溶液中的离子反应为2C6H5O﹣+SO2+H2O=2C6H5OH+SO32﹣,故C错误;D.碳酸钙和醋酸在离子反应中应保留化学式,大理石溶于醋酸中的离子反应为CaCO3+2CH3COOH=Ca2++2CH3COO﹣+CO2↑+H2O,故D正确;故选D.【点评】本题考查离子反应方程式的书写,明确发生的化学反应是解答本题的关键,选项C为学生解答的难点,题目难度中等.7.短周期元素W、X、Y和Z的原子序数依次增大.元素W是制备一种高效电池的重要材料,X原子的最外层电子数是内层电子数的2倍,元素Y是地壳中含量最丰富的金属元素,Z原子的最外层电子数是其电子层数的2倍.下列说法错误的是()A.元素W、X的氯化物中,各原子均满足8电子的稳定结构B.元素X与氢形成的原子比为1:1的化合物有很多种C.元素Y的单质与氢氧化钠溶液或盐酸反应均有氢气生成D.元素Z可与元素X形成共价化合物XZ2【考点】原子结构与元素的性质.菁优网版权所有【专题】压轴题.【分析】首先,根据原子结构的特点,推断出W、X、Y和Z分别是什么元素;然后,根据元素的性质,对照各个选项,判断正误.【解答】解:因X原子的最外层电子数是内层电子数的2倍,是C元素,Y是地壳中含量最丰富的金属元素,为Al元素.Z原子的最外层电子数是其电子层数的2倍,是短周期元素,且W、X、Y和Z的原子序数依次增大,Z为S元素,W是制备一种高效电池的重要材料,是Li元素;A、W、X的氯化物分别为LiCl和CCl4,则Li+的最外层只有两个电子,不满足8电子的稳定结构,故A错误;B、元素X与氢形成的化合物有C2H2,C6H6等,故B正确;C、元素Y为铝,铝与氢氧化钠溶液或盐酸反应均有氢气生成,故C正确;D、硫和碳可形成共价化合物CS2,故D正确;故选A.【点评】本题考查元素的推断和元素的性质,充分利用原子结构的知识是解题的关键.二、解答题(共3小题,满分29分)8.(14分)0.80gCuSO4•5H2O样品受热脱水过程的热重曲线(样品质量随温度变化的曲线)如图所示.5请回答下列问题:(1)试确定200℃时固体物质的化学式CuSO4•H2O(要求写出推断过程);(2)取270℃所得样品,于570℃灼烧得到的主要产物是黑色粉末和一种氧化性气体,该反应的化学方程式为CuSO4CuO+SO3↑.把该黑色粉末溶解于稀硫酸中,经浓缩、冷却,有晶体析出,该晶体的化学式为CuSO4•5H2O,其存在的最高温度是102℃;(3)上述氧化性气体与水反应生成一种化合物,该化合物的浓溶液与Cu在加热时发生反应的化学方程式为2H2SO4(浓)+CuCuSO4+SO2↑+2H2O;(4)在0.10mol•L﹣1硫酸铜溶液中加入氢氧化钠稀溶液充分搅拌,有浅蓝色氢氧化铜沉淀生成,当溶液的pH=8时,c(Cu2+)=2.2×10﹣8mol•L﹣1(Ksp[Cu(OH)2]=2.2×10﹣20).若在0.1mol•L﹣1硫酸铜溶液中通入过量H2S气体,使Cu2+完全沉淀为CuS,此时溶液中的H+浓度是0




 三七文档所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。
三七文档所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。
本文标题:2011年全国统一高考化学试卷(新课标卷)答案与解析
链接地址:https://www.777doc.com/doc-4579223 .html