当前位置:首页 > 商业/管理/HR > 咨询培训 > 高一化学竞赛练习(原创-江苏扬州中学)
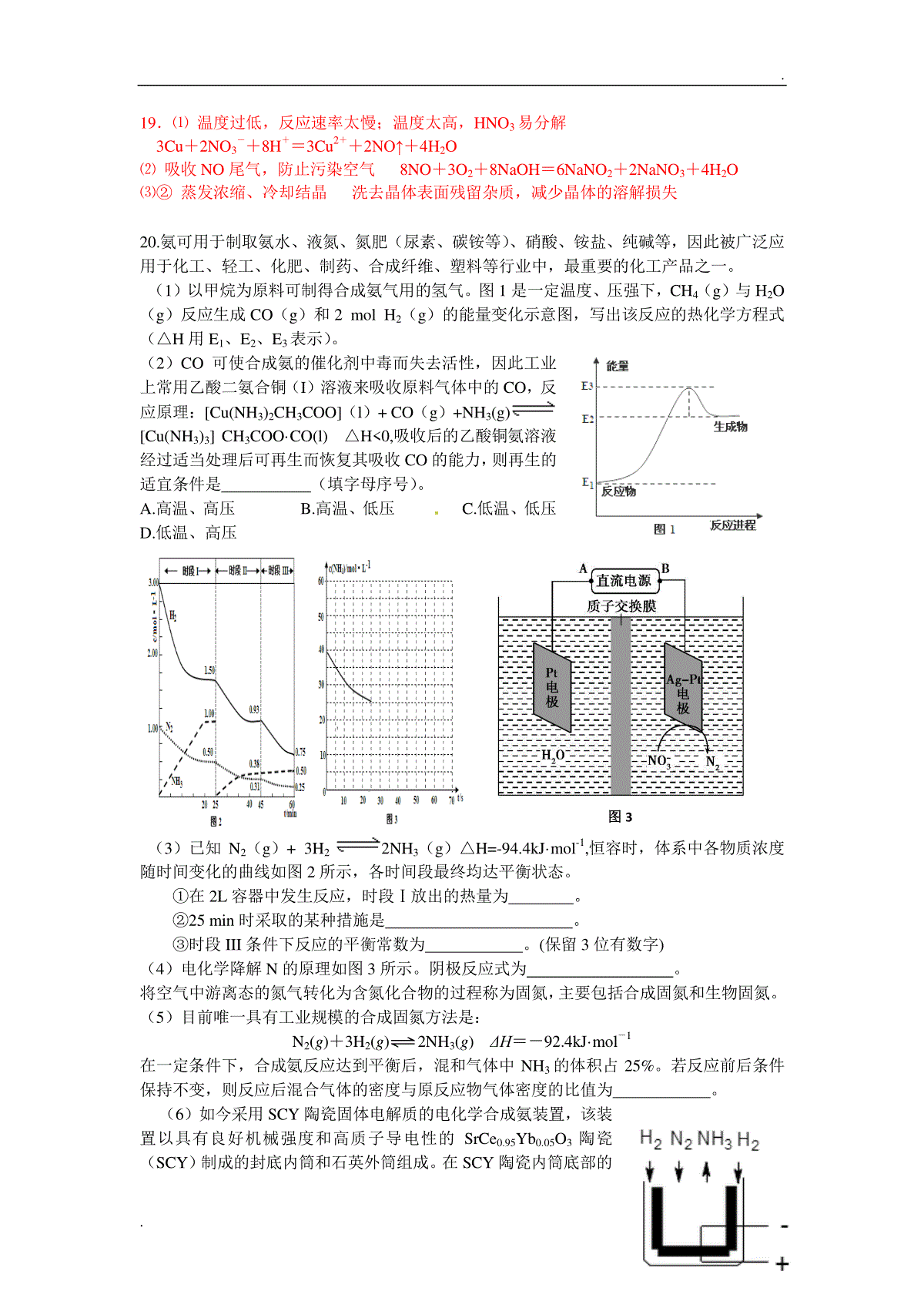
..高一化学竞赛练习1.在解答本卷时可以使用非编程计算器。2.参考公式:理想气体方程pV=nRT,其中R取8.314。可能用到的相对原子质量:H1Li7B11C12N14O16Na23S32Cl35.5选择题(共50分)单项选择题:本题包括10小题,每小题3分,共计30分。每小题只有一个....选项符合题意。1.2016年1月8日,国家科学技术奖在京揭晓:由吉林大学马琰铭主持完成的“高压下钠和锂单质及二元化合物的结构与物性”项目荣获国家自然科学奖二等奖。该课题围绕高压极端条件下金属——绝缘体转变这一核心科学问题开展的系统性高压相变研究。该项研究发现了高压下金属钠转变的奇异现象,并破解了金属锂的高压半导体相的结构谜团,实现了高压下金属——绝缘体转变这一高压相变领域多年期盼的科学夙愿。据此,可以推测下列说法错误..的是()A.从图(I)中可以看出金属钠在110万大气压下具有金属光泽,在130万大气压下变成黑色,在200万大气压下变得透明。B.图(II)为高压下绝缘体钠的hP4结构图和差分电荷密度图,钠的价电子受芯电子的库仑排斥作用被束缚到晶格间隙之中,无法自由运动,但依然保持一定的金属特性。C.人们所熟知的很多不导电的材料,在足够高的压力下都会变为导体,这一基本规律已经被人们广泛接受和认可。导电性很好的金属钠,在高压下会转变为绝缘体,可以说这个发现给人们的认知提供了一个反传统的认识。D.宇宙星体、地球内部都处于高压状态,这项研究对于理解处于高压状态下一些物质的行为具有重要意义,特别是为研究星体和地球内部构造提供了理论支持。2.近来全球范围内的恐怖袭击频发,各国民众的生命财产安全受到了巨大的威胁。了解各种炸药的组分和性质对安保工作的有效开展来说至关重要。请根据所学知识,判断下列关于各种炸药的说法正确的是()A.炸药源于我国。至迟在唐代,我国已发明“黑火药”,这是世界上最早的炸药。宋代,黑火药已被广泛用于战争,它需要通过明火点燃,爆炸效力巨大。B.硝化甘油的分子式为C3H5N3O9,是一种烈性液体炸药,轻微震动即会爆炸,曾以危险图(I)图(II)..性大而著称。1862年英国的P·沃尔夫最终通过“温热法”安全地制得了硝化甘油,使硝化甘油的工业批量化生产做出巨大贡献。C.TNT全称三硝基甲苯,是一种威力很强而又相当安全的炸药,即使被子弹击穿一般也不会燃烧和起爆。它在20世纪初开始广泛用于装填各种弹药和进行爆炸,逐渐取代了苦味酸(全称2,4,6-三硝基苯酚),被称为“炸药之王”。D.C4塑胶炸药是一种新型炸药,名称由来是其空间网状延展结构的每个结构基元含有4个碳原子。它是一种高效的易爆炸药,如果外边附上黏着性材料,就可以像口香糖那样牢牢地黏附在上面。这种炸药能轻易躲过X光安全检查,这一点也是恐怖分子喜欢使用的原因。3.下列有关化学用语正确的是A.NH4Cl的电子式:Cl-B.2-戊烯的结构简式:CH3CH2CH=CHCH3C.S2-的结构示意图:D.质子数为94、中子数为144的钚(Pu)原子:14494Pu4.下列有关物质的性质与应用均正确的是A.Na2O2是碱性氧化物,具有强氧化性可用于杀菌消毒B.氨气是一种碱性气体,可用P2O5或无水CaCl2干燥C.SO2和Cl2都能使品红溶液褪色,两者等体积混合可以增强漂白能力D.油脂在碱性条件下易水解,可用于制作肥皂5.工业上通过反应“SiO2+2C高温Si+2CO”制取单质硅,下列说法正确的是A.自然界中硅元素均以SiO2形式存在B.高纯度晶体Si可用于制造光导纤维C.该反应条件下C的还原性比Si强D.生成4.48LCO时转移电子数为0.4×6.02×10236.下列指定反应的离子方程式正确的是A.Cu与FeCl3溶液的反应:Cu+2Fe3+=Cu2++2Fe2+B.Na2SiO3溶液中加入盐酸:Na2SiO3+2H+=H2SiO3↓+2Na+C.AgCl悬浊液中加入KI溶液得到黄色沉淀:Ag++I-=AgI↓D.AlCl3溶液中加入过量氨水:Al3++4NH3·H2O=AlO2-+4NH4++2H2O7.短周期主族元素X、Y、Z、W原子序数依次增大,X原子最外层有7个电子,Y原子最外层电子数是最内层电子数的一半,Z最高正价是最低负价绝对值的3倍。下列叙述正确的是A.Y的离子半径比X的离子半径大B.化合物Y2Z中既有离子键、又有共价键C.Y、W最高价氧化物对应水化物的溶液均能溶解氧化铝D.简单气态氢化物的稳定性由强到弱的顺序:Z、W、X8.下表所列各组物质中,物质之间不能..通过一步反应实现如图所示转化的是物质选项甲乙丙甲乙丙ASO2SO3H2SO4BNH4ClNH3NOCNaNaOHNaClDAl2O3AlCl3Al(OH)3+18288..9.利用图所示装置(电极均为惰性电极)可吸收SO2,并用阴极排出的溶液吸收NO2。下列说法正确的是A.a为直流电源的负极B.阴极的电极反应式为:2HSO-3+2H++e-===S2O2-4+2H2OC.阳极的电极反应式为:SO2+2H2O-2e-===SO2-4+4H+[来源:Zxxk.Com]D.电解时H+由阴极室通过阳离子交换膜到阳极室10.下列关于物质结构的8个命题中:①配位键在形成时,是由成键双方各提供一个电子形成共用电子对②干冰晶体的晶胞是面心立方结构③Ge是IVA族的一个主族元素,其核外电子排布式为Ge:[Ar]4s24p2,属于P区元素④非极性分子往往是高度对称的分子,比如BF3、PCl5、H2O2、CO2这样的分子⑤冰中存在极性共价键和氢键两种化学键的作用⑥Cu(OH)2是一种蓝色的沉淀,既溶于硝酸、浓硫酸,也能溶于氨水中⑦熔融状态的HgCl2不能导电,HgCl2的稀溶液有弱的导电能力且可作手术刀的消毒液,从不同角度分类HgCl2是一种共价化合物、非电解质、盐、分子晶体⑧氨水中大部分NH3与H2O以氢键(用“…”表示)结合成NH3·H2O分子,根据氨水的性质可知NH3·H2O的结构式可记为其中,错误的有几项?()A.4项B.5项C.6项D.7项不定项选择题:本题包括5小题,每小题4分,共计20分。每小题只有一个或两个.....选项符合题意。11.下列说法正确的是A.一定温度下,反应2NaCl(s)===2Na(s)+Cl2(g)的△H<0,△S>0B.温度一定时,向水中滴加少量酸或碱形成稀溶液,水的离子积常数Kw不变C.常温下,将pH=4的醋酸溶液稀释后,溶液中所有离子的浓度均降低D.由于Ksp(BaSO4)<Ksp(BaCO3),因此不可能使BaSO4沉淀转化为BaCO3沉淀12.T℃时,在VL恒容密闭容器中加入足量的TaS2(s)和1molI2(g),发生反应TaS2(s)+2I2(g)TaI4(g)+S2(g)△H>0。tmin时生成0.1molTaI4。下列说法正确的是A.0~tmin内,v(I2)=0.1Vtmol·L-1·min-1B.若T℃时反应的平衡常数K=1,则平衡时I2的转化率为2/3C.图7制备TaS2晶体过程中循环使用的物质是S2(g)D.图7中T1端得到纯净TaS2晶体,则温度T1<T213.一定温度下,有两个体积均为2L的恒容密闭容器Ⅰ和Ⅱ,向Ⅰ中加入1molCO和2molH2,向Ⅱ中加入2molCO和4molH2,均发生下列反应并建立平衡:CO(g)+2H2(g)CH3OH(g)。测得不同温度下CO平衡转化率如右图所示。下列说法正确的是A.该反应的ΔH>0B.N点化学平衡常数K=0.59C.L、M两点容器内压强:P(M)>2P(L)100200300温度/℃1.00.80.60.40.20ⅠⅡ···CO转化率LMN..D.向N点平衡体系中再加入1molCH3OH,建立新平衡时被分解的CH3OH物质的量小于0.4mol14.下列根据实验操作和现象所得出的结论正确的是选项实验操作实验现象结论A取等物质的量的两种金属单质X、Y,分别与足量的盐酸反应X产生氢气的体积比Y多金属性:XYB等体积pH=3的HA和HB两种酸分别与足量的锌反应,排水法收集气体HA放出的氢气多且反应速率快HA酸性比HB强[来源:学科网ZXXK]C在CuSO4溶液中加入KI溶液,再加入苯,振荡有白色沉淀生成,苯层呈紫色白色沉淀可能为CuID取久置的Na2O2粉末,向其中滴加过量的盐酸产生无色气体Na2O2没有变质15.在体积为2L的恒容密闭容器中发生反应xA(g)+yB(g)zC(g),图I表示200℃时容器中A、B、C物质的量随时间的变化,图Ⅱ表示不同温度下平衡时C的体积分数随起始n(A):n(B)的变化关系。则下列结论正确的是200℃起始时n(A):n(B)平衡时C的体积分数图Ⅱ00.20.40.60.8t/min5图ⅠABCa100℃n/molA.200℃时,反应从开始到平衡的平均速率v(B)=0.02mol·L-1·min-1B.图Ⅱ所知反应xA(g)+yB(g)zC(g)的△H0,且a=2C.若在图Ⅰ所示的平衡状态下,再向体系中充入He,重新达到平衡前v(正)v(逆)D.200℃时,向容器中充入2molA和1molB,达到平衡时,A的体积分数小于0.5非选择题(共25空,计50分)19.硫酸铜可用作镀铜离子添加剂。实验室在如图所示装置(夹持、加热装置省去未画)内反应生成硫酸铜和少量硫酸铁,再进一步从所得溶液中获得硫酸铜晶体。请回答下列问题:⑴加热三颈烧瓶,将反应温度控制在70℃~80℃,其原因是,发生主要反应的离子方程式是。⑵盛有NaOH溶液洗气瓶的作用是;若反应后生成NaNO2、NaNO3的物质的量之比为3∶1,则发生反应的化学方程式是。⑶从反应后的混合溶液中获得硫酸铜晶体的操作步骤如下:①向溶液中加入CuO至溶液pH约为4,过滤。②将滤液,过滤、用乙醇洗涤、低温干燥,得CuSO4·5H2O晶体。用乙醇代替蒸馏水洗涤晶体的目的是,并缩短干燥所需时间。NaOH溶液空气稀HNO3稀H2SO4Cu(含杂质Fe)..19.⑴温度过低,反应速率太慢;温度太高,HNO3易分解3Cu+2NO3-+8H+=3Cu2++2NO↑+4H2O⑵吸收NO尾气,防止污染空气8NO+3O2+8NaOH=6NaNO2+2NaNO3+4H2O⑶②蒸发浓缩、冷却结晶洗去晶体表面残留杂质,减少晶体的溶解损失20.氨可用于制取氨水、液氮、氮肥(尿素、碳铵等)、硝酸、铵盐、纯碱等,因此被广泛应用于化工、轻工、化肥、制药、合成纤维、塑料等行业中,最重要的化工产品之一。(1)以甲烷为原料可制得合成氨气用的氢气。图1是一定温度、压强下,CH4(g)与H2O(g)反应生成CO(g)和2molH2(g)的能量变化示意图,写出该反应的热化学方程式(△H用E1、E2、E3表示)。(2)CO可使合成氨的催化剂中毒而失去活性,因此工业上常用乙酸二氨合铜(I)溶液来吸收原料气体中的CO,反应原理:[Cu(NH3)2CH3COO](l)+CO(g)+NH3(g)[Cu(NH3)3]CH3COO·CO(l)△H0,吸收后的乙酸铜氨溶液经过适当处理后可再生而恢复其吸收CO的能力,则再生的适宜条件是(填字母序号)。A.高温、高压B.高温、低压C.低温、低压D.低温、高压(3)已知N2(g)+3H22NH3(g)△H=-94.4kJ·mol-1,恒容时,体系中各物质浓度随时间变化的曲线如图2所示,各时间段最终均达平衡状态。①在2L容器中发生反应,时段Ⅰ放出的热量为。②25min时采取的某种措施是。③时段III条件下反应的平衡常数为。(保留3位有数字)(4)电化学降解N的原理如图3所示。阴极反应式为。将空气中游离态的氮气转化为含氮化合物的过程称为固氮,主要包括合成固氮和生物固氮。(5)目前唯一具有工业规模的合成固氮方法是:N2(g)+3H2(g)⇌2NH3(g)ΔH=-92.4kJ·mol-1在一定条件下,合成氨反应达到平衡后,混和气体中NH3的体积占25%。若反应前后条件保持不变,则反应后混合气体的密度与原反应物气体密度的比值为。(6)如今采用SCY陶瓷固体电解质的电化学合成




 三七文档所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。
三七文档所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。
本文标题:高一化学竞赛练习(原创-江苏扬州中学)
链接地址:https://www.777doc.com/doc-5209948 .html