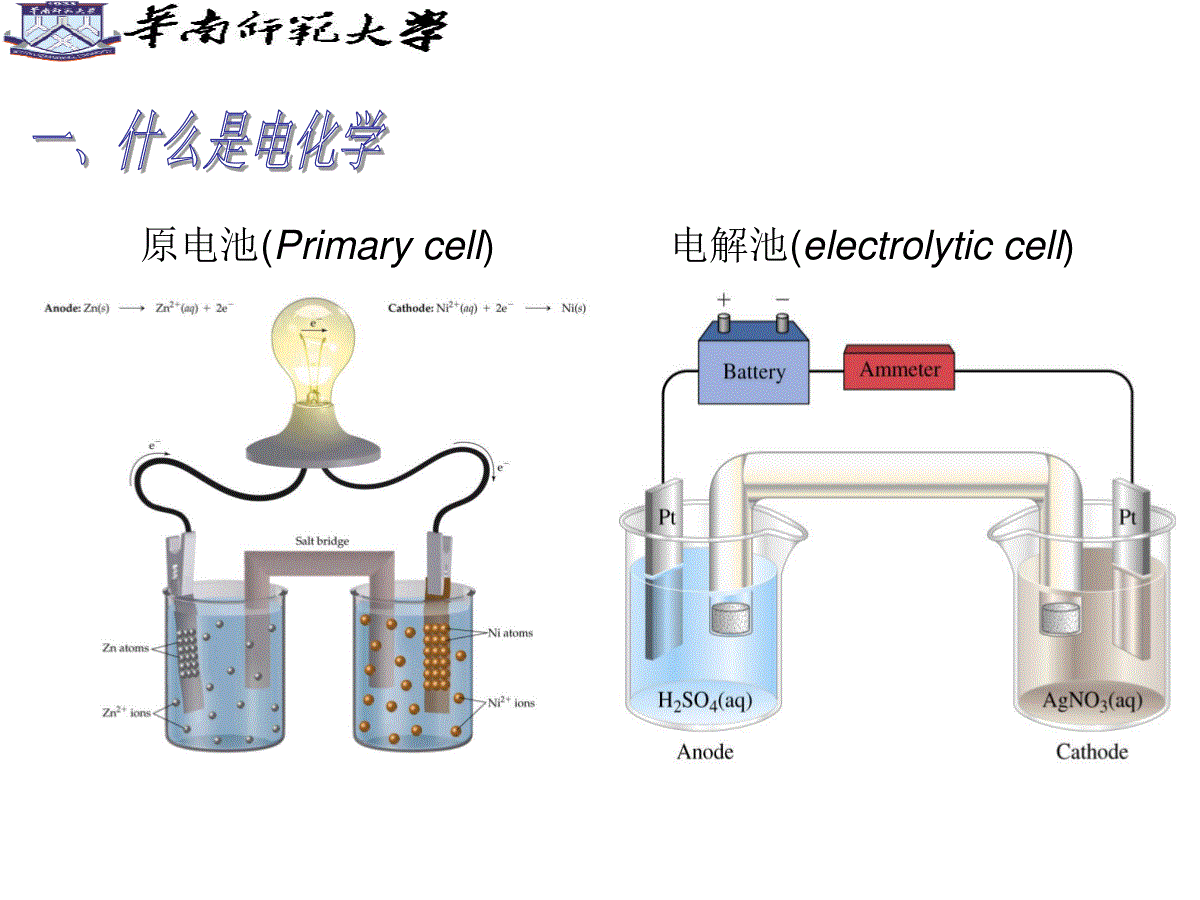
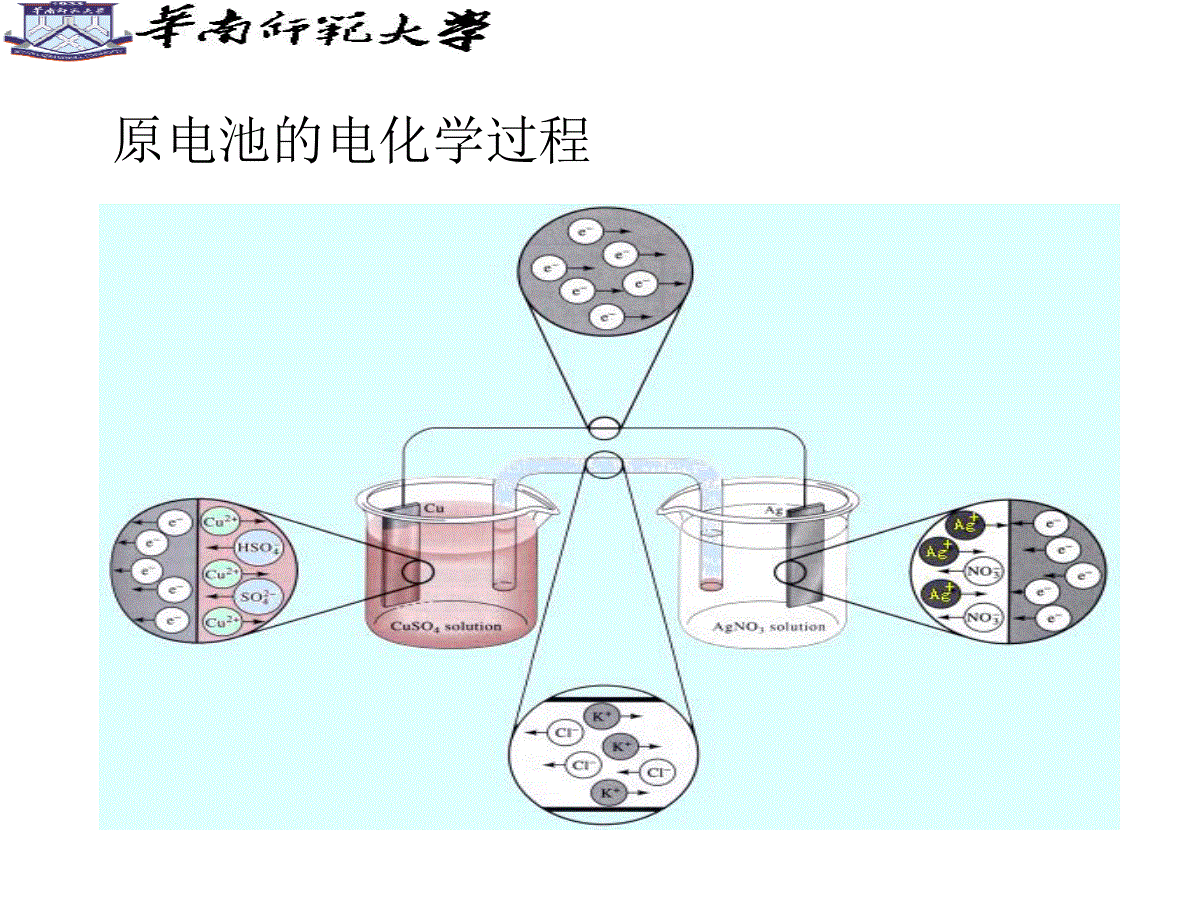
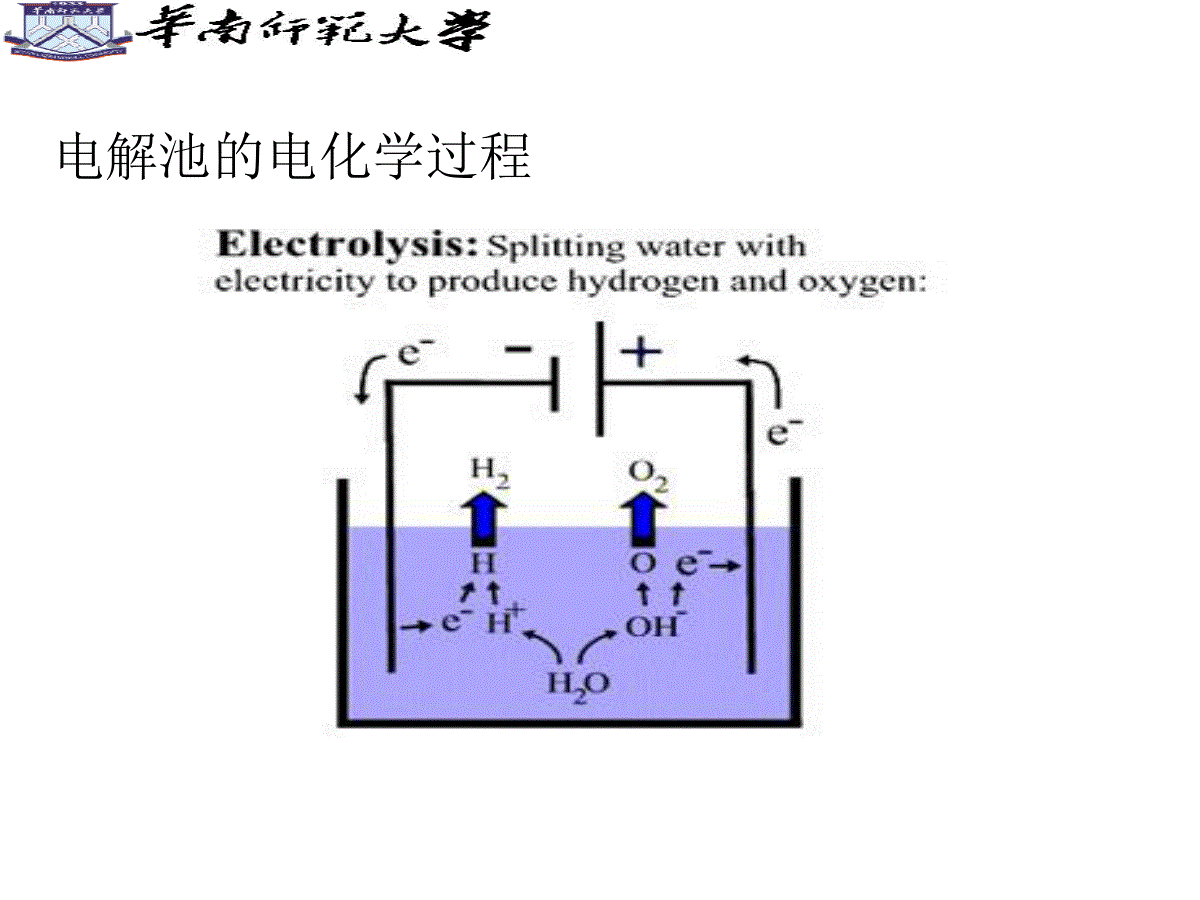
电化学基础ElectrochemicalFoundation吕东生电化学研究所,dhx@scnu.edu.cn第一章导论Introduction原电池(Primarycell)电解池(electrolyticcell)原电池的电化学过程电解池的电化学过程电化学是研究化学能和电能之间相互转化规律的一门科学。主要研究电子导体-离子导体、离子导体-离子导体的界面现象(带电界面现象)、结构和化学过程以及与此相关现象的科学。电能化学能电解电池电化学反应和一般化学反应的区别电化学有时比化学法优越(容易发生,环境污染少)。通过改变槽电压、电极材料、电解液组成及浓度来调节所需的电化学反应速率和选择性。在这方面电化学法有时比化学法更优越,许多化学法不能完成或很困难的反应,电化学法则很容易实现,且成本低、环境污染少。电化学反应是指在电极和溶液界面上进行电能与化学能之间的转变反应。1.电池(Battery)锌锰电池(Zn/MnO2battery)锌银电池(Zn/Ag2Obattery)铅酸蓄电池(Leadacidbattery)锂离子电池(Liionbattery)镍氢电池(Ni/MHbattery)燃料电池(FuelCell)燃料电池的结构2.电镀(Electroplating)镀金手饰镀钛合金风扇镀铜饰球塑料电镀电泳镀膜:用非金属物质涂覆在金属表面上形成保护层电镀车间电镀原理3.电合成(Electrosynthesis)氯碱工业2H2O(l)+2NaCl(aq)——Cl2(g)+H2(g)+2NaOH(aq)二氧化锰(EMD)4.电化学微加工(ElectrochemicalMicrofabrication)b)组装后的电磁驱动微马达的SEM照片,由牺牲层和LIGA技术获得,转子直径为150m,三个齿轮的直径分别为77m,100m和150ma)LIGA工艺得到的三个镍材料的微型齿轮,每个齿轮高100mLIGA工艺形成的微齿轮与微马达集成电路板制备纳米金属薄膜1.界面电化学(电化学界面微观结构、电化学界面吸附、电化学界面动力学)ATR-SEIRASStudyoftheAdsorptionofAcetateAnionsatChemicallyDepositedSilverThinFilmElectrodes2.生物电化学(生物膜的界面结构和界面电位、生物分子电化学、生物电催化、生物技术中的电化学技术)AmplifiedElectrocatalysisatDNA-ModifiedNanowires3.电催化PreparationandCharacterizationofHighlyOrderedGraphiticMesoporousCarbonasaPtCatalystSupportforDirectMethanolFuelCells4.电合成ControllableTemplateSynthesisofSuperconductingZnNanowireswithDifferentMicrostructuresbyElectrochemicalDepositionElectric-FieldAssistedGrowthandSelf-AssemblyofIntrinsicSiliconNanowires5.电化学传感器(ElectrochemicalSenior)NovelIntegratedElectrochemicalNano-BiochipforToxicityDetectioninWater1600Gilbert(英)发现摩擦生电WilliamGilbert(1544-1603)Gilbertisshowinghisscientific1791Galvani(意大利)发现生物电现象Galvani(1737-1798)“伽伐尼青蛙实验”原理图1799Volta(意大利)发明电池AlessandroVolta(1745-1827)Voltabattery1800Nicholson-Carlisle(英)电解水WilliamNicholson(1753-1815)nicholson_electrolysis1807Davy(英)电解制碱金属DavyHumphry(1778-1829)1833Faraday(英)电解定律MichaelFaraday(1791-1867)1839Grove(英)氢氧燃料电池SirWilliamRobertGrove1900Nernst(德)Nernst方程WaltherHermannNernst(1864-1941)1884Arrhenius(瑞典)电离学说SvanteAugustArrhenius(1859–1927)1923Debey(荷兰)-Huckel(德)离子互吸理论ErichHückel(1896-1980)德拜-休克尔的离子氛模型1879Helmholtz(德)双电层理论HermannvonHelmholtz(1821-1894)1905Tafel(德)Tafel方程JuliusTafel(1862-1918)参考书目:1.傅献彩等编,物理化学(下册),南京大学出版社2.李荻编,电化学原理,北京航天大学出版社平衡体系的电化学(一)第二讲电极电位(ElectrodePotential)电极电位是如何产生的?最终在电极/液体界面形成双电层Question11.简述金属Fe浸入含有Fe2+溶液中电极电势的形成过程。2.金属的平衡电极电势与那些主要因素有关?双电层(DoubleLayer)固体表面与液体本体之间的电位差,称为“热力学电势”φ;紧密层外界面与液体本体之间的电位差称为“电动电势”ζ,外加电解质浓度的变化会引起电动电位显著的变化。因为外加电解质浓度加大时会使进入紧密层的反号离子增加,从而使扩散层变薄,ζ电势下降。热力学电势和电动电势Question双电层模型中涉及到电动电势(ζ电势)和表面电势(ψ热力学电势),请问这两个概念的意义分别是什么?有何差别?接触电势(ContactPotential)两种金属相接触时,在界面上产生的电势差。液体接界电势(LiquidPotential)或扩散电势(DiffusionPotential)在两种含有不同溶质的溶液界面上,或者两种溶质相同而浓度不同的溶液界面上,存在微小的电位差液体接界电势的减少盐桥(SaltBridge)Question2.简述盐桥减少液体接界电势的作用机制和选择盐桥时的注意事项。1.什么是液体接界电势?电极电位的计算和测量(一)原电池的电动势(-)Zn|ZnSO4(C1)|CuSO4(C2)|Cu(+)E=ε++ε-+ε接触+ε扩散ε+和ε-分别表示电极与溶液的电势差ε接触表示接触电势差ε扩散表示液体接界电势标准氢电极(StandardHydrogenElectrode,SHE)mH+=1.0mol/kgγm=1αH+=1电极电势的定义:使待测电极与标准氢电极组合成原电池标准氢电极||待测电极规定该原电池的电动势就是待测电极的电极电势,并表示为当待测电极中参加反应的各物质均处于各自的标准状态时,待测电极的电极电势称为标准电极电势,表示为对于标准氢电极,标准电极电势(StandardElectrodePotential)[例](1)铜电极)(CuCu2a|实测上述电池的电动势Emf按规定即为铜电极的电极电势当a+=1.0时,上述电池电动势Emf=0.337V,则铜电极的标准电极电势一般而言,任一电极其电极反应用下列通式表示:RedeOxR-Oz其电极电势的通式为:Question电极电势是否就是电极表面与电解质溶液之间的电势差?使用能斯特方程计算得到的是什么电势?平衡体系的电化学(二)第三讲电极电位的计算和测量(二)1.标准电极电位(StandardElectrodePotential)电极电位的定义:使待测电极与标准氢电极组合成原电池标准氢电极||待测电极规定该原电池的电动势就是待测电极的电极电势,并表示为(待测电位)当待测电极中参加反应的各物质均处于各自的标准状态时,待测电极的电极电位称为标准电极电位,表示为øø意义:电极反应中各种物质均处于标准状态(c为1mol·L;P为100KPa;液体或固体都是纯净的物质。)ø是一个非常重要的物理量,它将物质在水溶液中的氧化还原能力定量化。ø高,说明电对中氧化型物质在标态下氧化能力强,还原型物质还原能力弱;ø低,说明电对中氧化型物质在标态下氧化能力弱,还原型物质还原能力强。【应用ø注意事项】(1)由于介质酸碱性影响ø值,ø表分酸表与碱表。(2)ø大小反映物质得失电子的能力,强度性质,与电极反应写法无关。Ag++e-=Ag;2Ag++2e-=2Ag;Ag=Ag++e-均为øAg+/Ag=0.779V+Ag/=0.779VAg+Ag/=0.779VAg(3)ø不适用于非水溶液体系。标准电极电位:在电极反应条件下,对某物质氧化型得电子或还原型失电子能力的量度电对的电极电位数值越正,该电对中氧化型的氧化能力(得电子倾向)越大,2.标准电极电位表电对的电极电位数值越负,还原型还原能力越强V76.0/ZnZn2V34.0/CCu2u要求:根据电对的电极电位,判断金属或离子相对氧化(还原)能力的强弱ø是强度物理量无加和性质Cu2++2e=Cu2Cu2++4e=2Cu标准电极电位表金属的活动性是反映金属在水溶液里形成水合离子倾向的大小,也就是反映金属在水溶液里起氧化反应的难易,它是以金属的标准电极电势为依据的。从能量角度来看,金属的标准电极电势除了与金属元素原子的电离能有关外,同时还与金属的升华能(固态单质变为气态原子时所需的能量)、水合能(金属阳离子与水化合时所放出的能量)等多种因素有关。金属活泼性通常用金属元素原子的最外层电子的电离能(气态原子失去电子成为气态阳离子时所需要的能量)大小来衡量。Question1.高锰酸钾溶液在什么条件下能氧化Br-?2.卤素单质与酸性Fe2+溶液反应的产物分别是什么?3.硫酸亚铁溶液在空气中稳定吗?例题:已知Fe3++e=Fe2+=0.77VCu2++2e=Cu=0.34VFe2++e=Fe=0.44VAl3++3e=Al=1.66V则最强的还原剂是:A.Al3+;B.Fe;C.Cu;D.Al.二、能斯特公式应用:用来计算非标准态下的电极电位。反映:电极电位与反应温度,反应物的浓度或分压的定量关系。电极反应:aOx+ne-=aRed能斯特公式:一般是常温298K时:/0.05916[]lg[Re]aaOxnd【使用公式注意事项】(1)气体,应以相对分压代入浓度项P/Pθ(2)纯固体、纯液体,不列出即作1;(3)公式中Ox、Red(广义的氧化型、还原型物质)包括参加了反应但氧化数未变化的物质,即所有参加电极反应的物质。【例】298KNO3-(aq)+4H+(aq)+3e-=NO(g)+2H2O(l)3343//0.05916lg/NONONONOcNOcHnpNOPEX:应用能斯特方程写出下面电极的电极电位表示式:1.MnO2+4H++2e-=Mn2++2H2O2.ClO3–+6H++5e-=1/2Cl2+3H23.MnO4+8H++5e-=Mn2++4H2OQuestion电极电位是否就是电极表面与电解质溶液之间的电势差?单个电极的电位能否测量?使用能斯特方程计算得到的是什么电位?平衡体系的电化学(三)第四讲A.可逆电池式的书写(-)Zn(s)|ZnNO3(1M)||CuNO3(1M)|Cu(s)(+)(-)Pt,H2(g)|HCl(1M)|Cu2+(1M)|Cu(s)(+)Zn(s)|Zn2+(1M)||HCl(1M)|H2(g)ABAB错在哪里?Pt|Fe2+(0.10M),Fe3+(0.20M)||Ag+(1.0M)|Ag(s)Pt,H2(g,1atm)|H+(xM)||H+(1.0M)|H2(g,1atm),Pt(s)A


 三七文档所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。
三七文档所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。
本文标题:电化学基础
链接地址:https://www.777doc.com/doc-6987850 .html