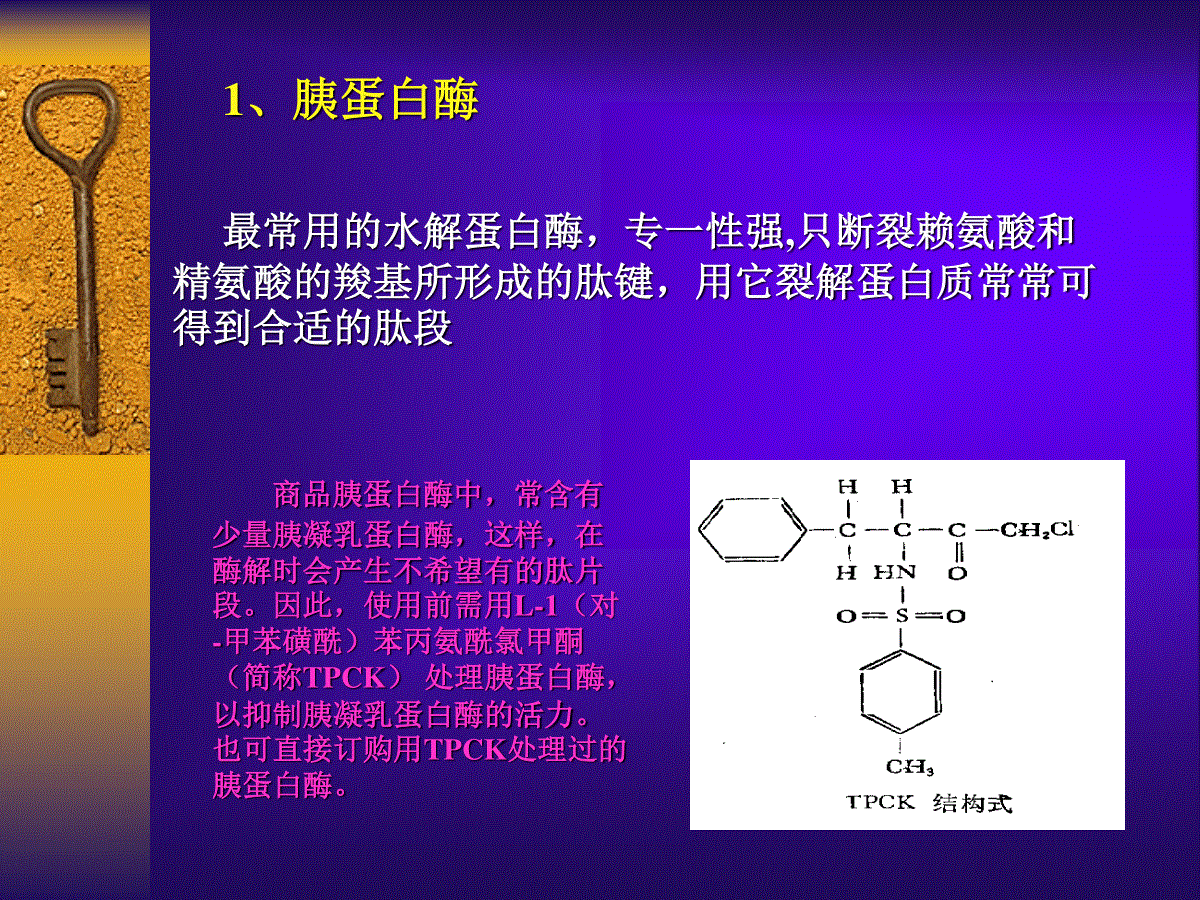
第五章蛋白质的裂解用Edman降解法测多肽链的氨基酸顺序,一次只能连续降解数十个残基,用手工方法最多测二十多个残基。然而,自然界蛋白质的分子量通常在一万以上,因此在测多肽链顺序时,需将它们先裂解成一系列小肽,分别测出它们的顺序,然后再找出它们的接头位置,才能定出该肽链的顺序。所以如何选择肽链裂解的切点,将对顺序测定起着重要作用裂解条件要求:裂解点少专一性强反应产率高裂解方法:酶法化学法酶解和化学裂解是顺序分析中互为补充缺一不可的手段一、引言早期:部分酸水解法裂解,由于专一性低,裂解后生成很多小肽,造成分离纯化困难,工作量也很大。中期:生化学家改用蛋白酶酶解,因专一性强,故被广泛地使用。后来:随着自动顺序仪的广泛使用和对大肽段的需求,发现某些化学试剂对蛋白质的裂解有特异的优点。化学法再流行。(-)简述用特异性水解酶裂解肽链有许多优点:专一性强,降解后的肽段容易纯化,产率较高,副反应少,在酸水解中容易受破坏的谷氨酰氨、天冬酰氨和色氨酸等在酶解中都不受影响。整个酶解反应中,酶解条件的选择相当重要,需要考虑下列因素:(1)合适的pH(2)适宜的反应温度(3)恰当的酶与底物的比率(4)选择相应的反应时间二、蛋白质的酶裂解最常用的水解蛋白酶,专一性强,只断裂赖氨酸和精氨酸的羧基所形成的肽键,用它裂解蛋白质常常可得到合适的肽段商品胰蛋白酶中,常含有少量胰凝乳蛋白酶,这样,在酶解时会产生不希望有的肽片段。因此,使用前需用L-1(对-甲苯磺酰)苯丙氨酰氯甲酮(简称TPCK)处理胰蛋白酶,以抑制胰凝乳蛋白酶的活力。也可直接订购用TPCK处理过的胰蛋白酶。1、胰蛋白酶讨论:如果蛋白质分子量较大,或遇到碱性蛋白含有较多的赖氨酸和精氨酸残基时,则酶解后的肽段数就会很多,将给顺序测定带来很大麻烦。方法:用柠康酸酐可逆保护赖氨酸的ε-氨基,使胰蛋白酶酶解时不会在赖氨酸羧端裂解,而只在精氨酸的羧端裂解,以后也很容易去掉保护基团。ε-氨基保护剂凝凝乳蛋白酶的前体是胰凝乳蛋白酶原,由245个氨基酸组成的单链,有5个二硫键。酶原本身没有水解活力,靠胰蛋白酶激活,在Arg15---Ile16肽键处水解,形成л-胰凝乳蛋白酶。而л-胰凝乳蛋白酶又反过来对本身起作用,酶解掉二个二肽Ser14-Arg15和Thr147-Asn148,生成具完全活力的a-胰凝乳蛋白酶。因此a一胰凝乳蛋白酶由A、B、C三条多肽链组成,它们分别含有13,130,96个氨基酸残基。2、胰凝乳蛋白酶凝凝乳蛋白酶的专一性不如胰蛋白酶,酶解Tyr,Phe、Trp、Len等疏水氨基酸羧基所形成的肽链,也能在val、Ile、Ser、Gly的羧端裂解,但较慢。如果被裂解的邻近基团是碱性的(如Lys、Arg或His),裂解能力将增加。倘若邻近是Pro或Phe—Pro,则不能酶解。在酶解中,增加酶的比例(对底物)能提高酶解能力,这时,甚至象Ala-val键也能酶解。凝凝乳蛋白酶专一性与胰凝乳蛋白酶类似适宜酶解pH值是2在顺序测定中很有价值,因为在确定二硫键的位置时,在这样的酸性环境下二硫键比较稳定,很少有二硫键的互换反应。反应条件选择恰当,可以变低特异性为高特异性。在pH2.5的水溶液中,用胃蛋白酶酶解胰岛素于3℃冰水浴恒温反应1.5h,此后用lNNaOH调pH=9以终止反应。结果用ScphadexG-50柱(3.0×110cm)分离得到了很纯的去B链羧端五肽胰岛素,说明胃蛋白酶在酶解中只降解胰岛素B链中第25位苯丙氨酸的羧基所形成的肽键(—Phc25--THR26-Thr27-Pro28-LyS29-aLA30)3.胃蛋白酶含金属的酶,锌原子和钙原子,锌是活力所必需的,钙使酶在高温下稳定,该酶易被EDTA所抑制。专一性比上面三种酶都差,用来直接酶解蛋白质不太合适,因为产生的肽段相对较多,不仅纯化起来麻烦,而且对以后的顺序重排也不利。如用它来裂解次级肽,即先用专一性较强的酶或化学试剂把蛋白质多肽链降解成大肽段,再切成小肽段时,嗜热菌蛋白酶可发挥很好的作用。胰凝乳蛋白酶、胃蛋白酶和嗜热菌蛋白酶有一个共同的特点,即它们的作用范为比较宽,并且主要裂解中性氨基酸残基。4.嗜热菌蛋白酶(三)几种高特异性的肽链内切酶在蛋白质顺序测定中,对较大分子量的蛋白质采用逐级特异性裂解是比较理想的。Glu蛋白酶Glu蛋白酶亦称金黄色葡萄球菌蛋白酶,是从金黄色葡萄球菌菌株V8中分离得到的,是最有效、应用最广泛的一个酶,分子量只有12,000。当酶解在磷酸缓冲液(pH7.8)中进行时,它能在谷氨酸和天冬氨酸残基的羧端处裂解肽键。用碳酸氢铵(pH7.8)或醋酸胺(pH4.0)时,则仅在谷氨酸的羧端处裂解。该酶对下列蛋白质只在谷氨酸的羧端处裂解:核糖体蛋白S7,L23,EL12,维生素A1结合蛋白,钙结合蛋白,a1[lll]胶原蛋白,ß2小球蛋白。Arg蛋白酶(1)Chostripain酶专一性裂解精氨酸羧端的蛋白酶。专一性很高;肽链的羧端是精氨酸;该酶在6mol/l尿素20小时内仍保持活力,这样对不溶性蛋白质的长时间裂解就很有效。(2)凝血酶(thrombin)是另一个作用精氨酸羧端的特异酶,对Arg-Gly键裂解特别快。(3)颌下腺蛋白酶也有裂解精氨酸所形成的肽键的专一性,对磷脂酰胆碱交换蛋白只裂解Arg-Glu键,对血纤维蛋白原只裂解Arg-Arg键。Lys蛋白酶选择性一般不如Arg蛋白酶专一1)密环菌(Armillariamellea)是裂解赖氨酸氨端肽键,条件是在赖氨酸残基的羧端必须联有谷氨酸、天冬氨酸或天冬酰胺残基。这个酶对精氨酸也具有活力,如在酶解天冬氨酸氨转移酶时,发现它在部分赖氨酸残基氨端裂解外,还同时裂解三个Arg-Leu(Ile)键2)血纤维蛋白酶裂解血纤维蛋白原时也发现除裂解部分的赖氨酸外,也裂解精氨酸氨端肽键3)MyxobactcrAI-1是另一种Lys蛋白酶。它是从一种粘细菌中提取的,也能在赖氨酸残基的氨端裂解,条件是,赖氨酸残基的羧端通常联有Tyr,Ala和Gln残基4)凝血酶样酶(thrombinenzyme)是Lys-Leu键的高特异性Lys蛋白酶。Pro蛋白酶特异性在Pro羧基所形成肽键处裂解的蛋白酶,从小羊肾中提取(四)实验方法1.胰蛋白酶裂解(l)TPCK一胰蛋白酶降解称1.0mg蛋白质+0.5ml双蒸水+0.5m10.2mol/lN-甲基吗啉缓冲液(pH8.1)+10-20ugTPCK-胰蛋白酶37℃保温反应4-6h冷冻干燥加50ul双蒸水溶解,离心上清液待分离纯化后供测顺序用胰蛋白酶(200mg)溶于62m10.001mo1/lCaCl2用3%NaOH调pH至7.0在15-20℃加人含6mgTPCK0.6ml无水甲醇溶液继续搅拌维持pH7.0约5.5h用pH3.0的盐酸水溶液透析2.5天然后冻干。(2)TPCK处理胰蛋白酶分离纯化(3)TPCK一胰蛋白酶活力的测定方法称底物苄酰L-精氨酰乙酶盐酸盐(Bcnzyl-L-Argininccthv1cster·HC1简称BAEE)3.9mg溶于10ml0.05mol/lTris缓冲液(pH=9.24)中,将TPCK处理过的胰蛋白酶lmg溶于10m10.001NHCI中,吸底物3ml在紫外分光光度计上(波长253nm处),调节光密度为0,然后加人0.2ml酶液。每隔30秒钟读一次光密度数,直至读数不变为止,一般在10分钟内稳定。活力单位计算公式:a.u.=-------------O.D.C酶(4)保护Lysε-NH2的方法①柠康酰化法:蛋白质溶于6mol/l盐酸胍或8mol/l尿素(20-30mg蛋白质/ml)在室温(20℃)下用12NNa○H调pH至8.0柠康酸酐25mg(10倍于蛋白质的量)激烈搅拌2小时,pH8.5左右透析或用SephadcxG-25柱除试剂和盐分离纯化②ETPA法:以ETPA与溶菌酶反应为例蛋白质硼酸缓冲液(0.2mol/lpH=8.8)12mg蛋白质/ml,过量的ETPA(按参与反应的Lys基团数计算)12倍,搅拌下分批滴加用lNNaOHpH=8.5-9.0加入ETPA时,产生沉淀2小时反应结束4℃透析(pH=8,5%(w/v)NH4HCO3)分离纯化③马来酰化法:称蛋白质(200mg)溶于10ml的0.lmol/l磷酸钠缓冲液冰浴冷却滴加300mg马来酸酐(溶于3ml无水三氧六环)用0.1N或0.5NNa○HpH=9.00℃下放置30min继续搅拌1h室温透析48h(外透液为2N氨水,pH8)冷冻干燥分离纯化2.胰凝乳蛋白酶裂解:酶解条件及缓冲液与胰蛋白酶相同,pH8.1,37℃,酶:底物=1:100,酶解1-4h3.嗜热菌蛋白酶裂解:缓冲液与胰蛋白酶相同pH8.1,50-55℃酶:底物=1:100或1:150,酶解2h以避免胰蛋白酶或胰凝乳蛋白酶的副反应4.胃蛋白酶裂解:1.0mg蛋白质+0.5ml0.05N醋酸或稀甲酸中,pH2.0+10ug胃蛋白酶(溶于10ul双蒸水)37℃下搅拌反应2h冰冻干燥随后溶于50ml双蒸水中离心分离纯化5.Gul蛋白酶裂解:蛋白质1.0mg溶于1.0m1醋酸铵缓冲液0.1mol,pH4.0加20ugGlu蛋白酶(溶于20ul双蒸水)搅拌酶:底物=1:5037℃下保温24-28小时冰冻干燥加50ul双蒸水溶解分离纯化6.Arg白酶裂解:蛋白质1.0mg溶于1.0ml双蒸水加8.0ugArg蛋白酶(溶于20ul双蒸水)37℃下搅拌反应1-4小时冰冻干燥再溶于50ul双蒸水待分离纯化分离纯化7.密环菌蛋白酶裂解:蛋白质1.0mg溶于0.5m10.1mol/l1N-甲基吗啉醋酸缓冲液或0.07%氨水(pH8.1)1ug酶溶于5ul双蒸水(酶:底物=1:1000)37℃下搅拌反应4-6h冷冻干燥50ul双蒸水溶解分离纯化供测顺序用三、蛋白质的化学裂解是蛋白质顺序测定中的另一重要手段产物的肽段一般都比较大裂解产物适合于在自动顺序仪中测定顺序产物有利于肽段的吻合因此化学法对较大分子量的蛋白质顺序测定是重要的缺点:因为化学裂解后的肽段较大。往往会遇到不溶解和集聚等问题,分离较困难,产率一般也比酶解为低。1.原理。溴化氰(CNBr)裂解法是多种化学法中最重要的也是最常见的方法。。由Gross和Witkop于1962年建立的。后人进行了系统研究,能专一裂解蛋氨酸残基的羧端,产率达到85%。由于蛋白质中的Met一般都比较少,因此裂解后的肽段较少,新生成的肽段往往是大肽段,这样很适合于自动顺序仪测定,更适用于固相法测定。与胰蛋白酶裂解法配合起来,通常很容易获得肽段的排列顺序(-)溴化氰裂解CNBr裂解蛋氨酸残基的反应机理:CNBr裂解肽链的甲硫氨酸羧基所形成肽链的反应在酸性条件下氨基质子化,可以避免一些副反应如:用70%甲酸可以破坏肽链的卷曲,使甲硫氨酸侧链暴露,有利于CNBr的裂解甲硫氨酸的氧化产物亚砜Met(SO)或砜Met(SO3)不能与CNBr反应为防止甲硫氨酸被氧化,整个反应应在氮气流或充氮容器中进行当甲硫氨酸在N末端,则产生游离的高丝氨酸内酯:当肽链中有二个相邻的甲硫氨酸,则产生一游离高丝氨酸内酯和二个新肽段:当甲硫氨酸在C末端,则C末端变为高丝氨酸内酯:2.实验方法蛋白质70%甲酸中(5-50mg蛋白/ml70%甲酸)加30-100倍过量CNBr通N2充分混合后室温(20℃)黑暗处放置24h加10倍量双蒸水稀释冰冻干燥或用70%三氟醋酸代替甲酸,25℃反应12h,然后用双蒸水稀释到5%三氟醋酸以终止反应分离纯化注意,如样品溶解度差,可3.讨论当甲硫氨酸在N末端时,反应常不完全,约有10%Met键保留下来,不被裂解,其原因是由于O-乙酰基取代了N一乙酰基。(二)羟胺裂解1.原理NH2OH能专一地裂解–Asn-Gly-之间的肽键,其反应机理是:通过NH2OH作用先形成一个琥珀酸亚胺环状物,最后导致–Asn-Gly-键的裂解,反应式如下:CONH2CH2OH--HN-CH-CO-NH-CH2-CO-例如:用NH2OH裂解DNA依赖的RNA聚合酶的ą-亚基,裂解后用SephadexG-100柱




 三七文档所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。
三七文档所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。
本文标题:蛋白质的裂解
链接地址:https://www.777doc.com/doc-7284343 .html