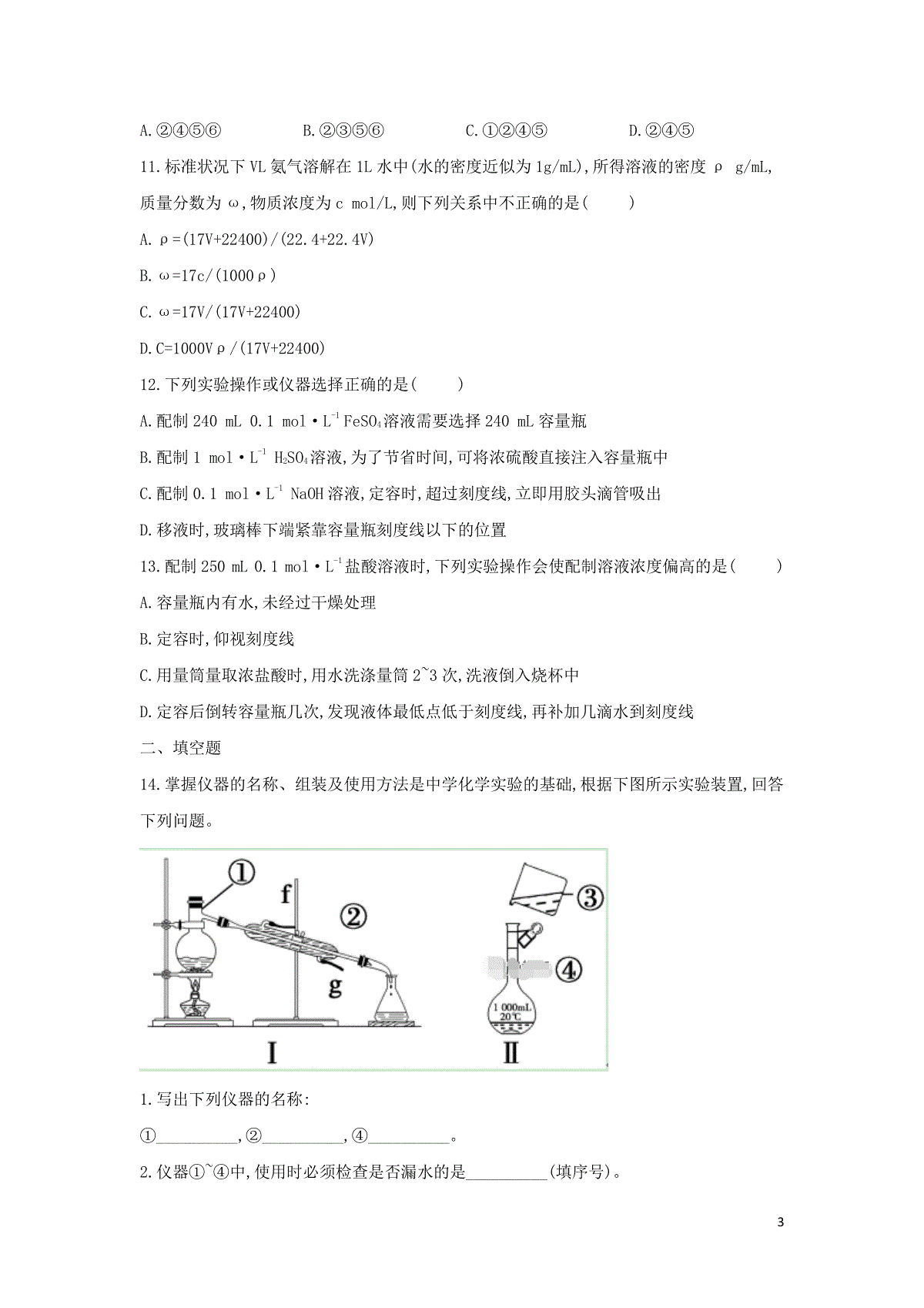
1EvaluationWarning:ThedocumentwascreatedwithSpire.Docfor.NET.2018-2019学年高一化学人教版寒假作业(6)物质的量在化学实验中的应用一、单选题1.实验室配制1mol·L-1硫酸500mL,下列不需用的仪器是:()A.500mL容量瓶B.托盘天平C.胶头滴管D.烧杯2.下列溶液中,Cl-的物质的量与50ml1mol/LAlCl3溶液中Cl-物质的量相等是()A.150ml3mol/LKCl溶液B.100ml0.75mol/LMgCl2溶液C.100ml1mol/LNaCl溶液D.15ml2mol/LAlCl3溶液3.实验室需配制一种强酸溶液500mL,c(H+)=2mol/L,下列配制方法可行的是()A.取100mL5mol/LH2SO4,加入400mL水B.取200mL5mol/LHCl,加水稀释至500mLC.取100mL5mol/LH2SO4,加500mL水D.取100mL5mol/LHNO3,加水稀释至500mL4.用NA表示阿伏加德罗常数的值。下列叙述正确的是()A.含有NA个氦原子的氦气在标准状况下的体积约为11.2LB.25℃、1.01×105Pa状态下,1molSO2中含有的原子总数为3NAC.常温常压下,11.2LCl2含有的分子数为0.5NAD.1L1.0mol·L-1盐酸中含有NA个HCl分子5.把100g某NaOH溶液(密度为1.22g/cm3),蒸发浓缩至50mL时物质的量浓度为8mol/L(蒸发浓缩时无固体析出),则原溶液的物质的量浓度为()①.160g/L②.3.28mol/L③.4.88mol/L④.16%A.①B.②④C.③④D.①③26.将标准状况下aLHCl溶于1L水中,得到的盐酸密度为bg/cm3,则该盐酸的物质的量浓度是()A./22.4amolLB./22400abmolLC.1000/2240036.5abmolLaD./2240036.5abmolLa7.已知98%的硫酸物质的量浓度为18.4mol·L-1,则49%的硫酸物质的量浓度是()A.小于9.2mol·L-1B.等于9.2mol·L-1C.大于9.2mol·L-1D.不能确定8.实验测得某溶液中仅含有K、2Cu、24SO、-Cl四种离子,其中K、2Cu、-Cl三种离子的个数比为4:5:8,则K与24SO的物质的量比为()A.4:3B.4:1C.2:3D.2:19.在Al2(SO4)3和MgSO4的混合溶液中,滴加NaOH溶液,生成沉淀的量与滴入NaOH溶液的体积关系如图所示,则原混合液中Al2(SO4)3与MgSO4的物质的量浓度之比为()A.6:1B.3:1C.2:1D.1:210.用已准确称量的氯化钠固体配制0.1mol/L的氯化钠溶液480mL,需要用到的仪器是()①烧瓶②烧杯③1000mL的容量瓶④500mL的容量瓶⑤胶头滴管⑥玻璃棒3A.②④⑤⑥B.②③⑤⑥C.①②④⑤D.②④⑤11.标准状况下VL氨气溶解在1L水中(水的密度近似为1g/mL),所得溶液的密度ρg/mL,质量分数为ω,物质浓度为cmol/L,则下列关系中不正确的是()A.ρ=(17V+22400)/(22.4+22.4V)B.ω=17c/(1000ρ)C.ω=17V/(17V+22400)D.C=1000Vρ/(17V+22400)12.下列实验操作或仪器选择正确的是()A.配制240mL0.1mol·L-1FeSO4溶液需要选择240mL容量瓶B.配制1mol·L-1H2SO4溶液,为了节省时间,可将浓硫酸直接注入容量瓶中C.配制0.1mol·L-1NaOH溶液,定容时,超过刻度线,立即用胶头滴管吸出D.移液时,玻璃棒下端紧靠容量瓶刻度线以下的位置13.配制250mL0.1mol·L-1盐酸溶液时,下列实验操作会使配制溶液浓度偏高的是()A.容量瓶内有水,未经过干燥处理B.定容时,仰视刻度线C.用量筒量取浓盐酸时,用水洗涤量筒2~3次,洗液倒入烧杯中D.定容后倒转容量瓶几次,发现液体最低点低于刻度线,再补加几滴水到刻度线二、填空题14.掌握仪器的名称、组装及使用方法是中学化学实验的基础,根据下图所示实验装置,回答下列问题。1.写出下列仪器的名称:①__________,②__________,④__________。2.仪器①~④中,使用时必须检查是否漏水的是__________(填序号)。43.若利用装置Ⅰ分离酒精和水的混合物,还缺少的仪器__________,将仪器补充完整后进行的实验操作的名称为__________;②的进水口是__________(填“f”或“g”)。4.现需配制250mL、0.2mol·L-1NaCl溶液,装置Ⅱ是某同学转移溶液的示意图,指出图中的错误操作:__________。15.下图是某学校实验室从化学试剂商店买回的浓硫酸试剂标签上的部分内容。现用该浓硫酸配制480mL1mol·L-1的稀硫酸。可供选用的仪器有:①胶头滴管②烧瓶③烧杯④玻璃棒⑤药匙⑥量筒⑦托盘天平。硫酸化学纯(CP)(500mL)品名:硫酸化学式:H2SO4相对分子质量:98密度:1.84g/cm3质量分数:98%请回答下列问题:1.在容量瓶的使用方法中,下列操作不正确的是__________A.使用容量瓶前检查它是否漏水B.容量瓶用蒸馏水洗净后,配制溶液不需要干燥C.配制溶液时,如果试样是固体,把称好的试样用纸条小心倒入容量瓶中,缓慢加入蒸馏水到接近标线1~2cm处,用滴管加蒸馏水到标线D.定容后盖好瓶塞用食指顶住瓶塞,用另一只手托住瓶底,把容量瓶上下颠倒摇匀几次2.配制稀硫酸时,还缺少的仪器有__________3.配制480mL1mol·L-1的稀硫酸需要用量筒量取上述浓硫酸的体积为__________mL。4.对所配制的稀硫酸进行测定,发现其浓度大于1mol·L-1,配制过程中下列各项操作可能引起该浓度偏高的原因有__________。A.定容时,仰视容量瓶刻度线进行定容。B.将稀释后的硫酸立即转入容量瓶后,紧接着就进行以后的实验操作。C.转移溶液时,不慎有少量溶液洒到容量瓶外面。D.容量瓶用蒸馏水洗涤后未干燥,含有少量蒸馏水。E.定容后,把容量瓶倒置摇匀后发现液面低于刻度线,便补充几滴水至刻度处。55.现将100mL0.5mol/L的盐酸200mL该浓度的硫酸溶液混合,体积变化忽略不计,所得溶液中H+的物质的量浓度是__________。6参考答案一、单选题1.答案:B解析:2.答案:B解析:3.答案:B解析:4.答案:B解析:5.答案:C解析:6.答案:C解析:7.答案:A解析:8.答案:A解析:溶液呈电中性,由电荷守恒得:+2+2--4nK?+1+nCu?+2+nSO?-2+nCl?-1=0。令+nK=4mol,则24nSO=3mol。点评:学会灵活运用电荷守恒。9.答案:D解析:10.答案:A解析:11.答案:A解析:712.答案:D解析:13.答案:C解析:A、配制最后需加水定容,容量瓶内有水,未经过干燥处理,对所配溶液浓度无影响,故A不符合;B、定容时仰视容量瓶刻度线,所配溶液体积偏大,导致所配溶液浓度偏低,故B不符合;C、量筒为流量式仪器,流出的体积即为量取溶液体积,洗涤量筒导致实际量取的盐酸的体积增大,所配溶液浓度偏高,故C符合;D、反复倒转摇匀后,液面低于刻度线,此时有少量溶液残留在玻璃塞和瓶口之间,浓度不变,属于正常现象,但又补充了水,所配溶液体积偏大,导致所配溶液浓度偏小,故D不符合.故选:C.二、填空题14.答案:1.蒸馏烧瓶;冷凝管;1000mL容量瓶2.④;3.温度计;蒸馏;g;4.未用玻璃棒引流,未选用250mL容量瓶解析:15.答案:1.C;2.500mL容量瓶;3.27.2;4.B;5.0.15mol/L解析:




 三七文档所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。
三七文档所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。
本文标题:2018-2019学年高一化学寒假作业(6)物质的量在化学实验中的应用(含解析)新人教版
链接地址:https://www.777doc.com/doc-7937327 .html