当前位置:首页 > 临时分类 > 高中化学竞赛辅导课件-第八章-原子结构
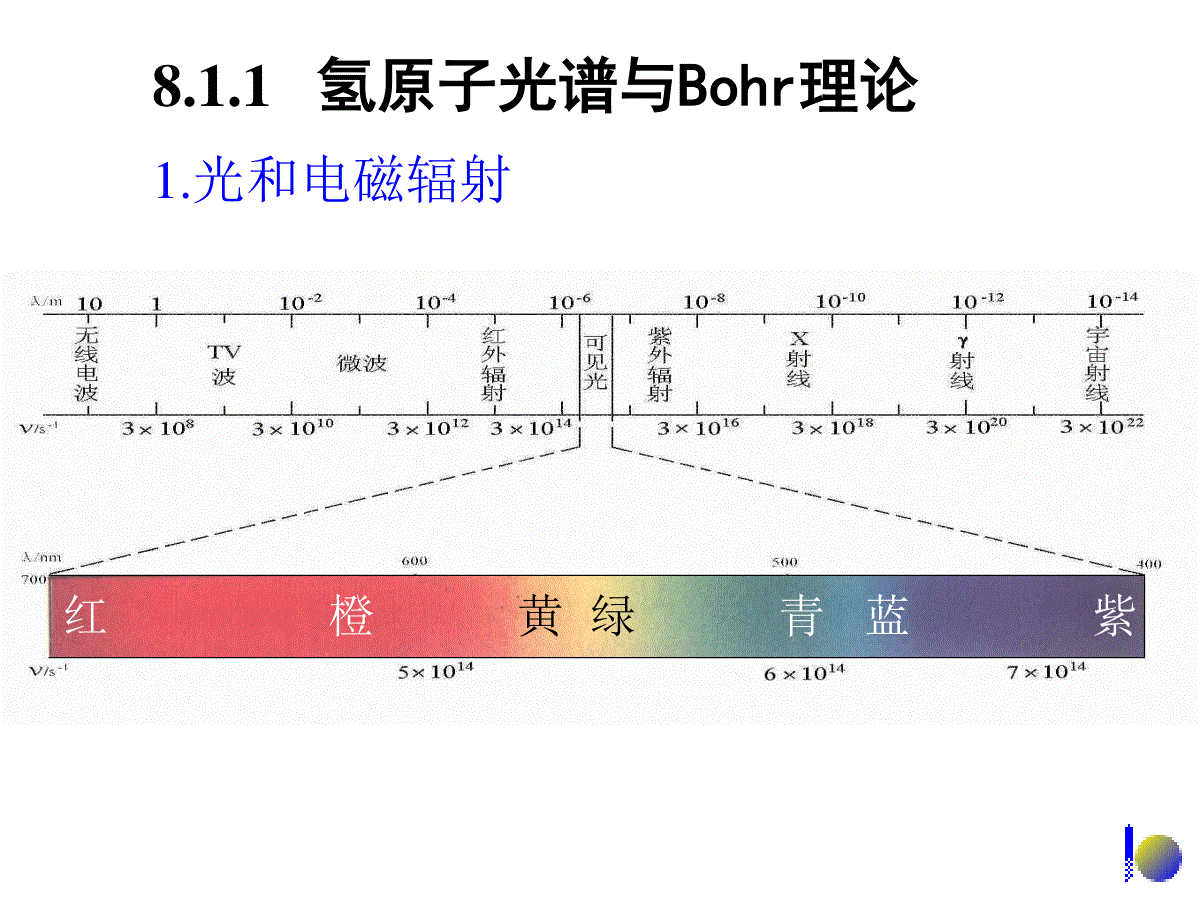
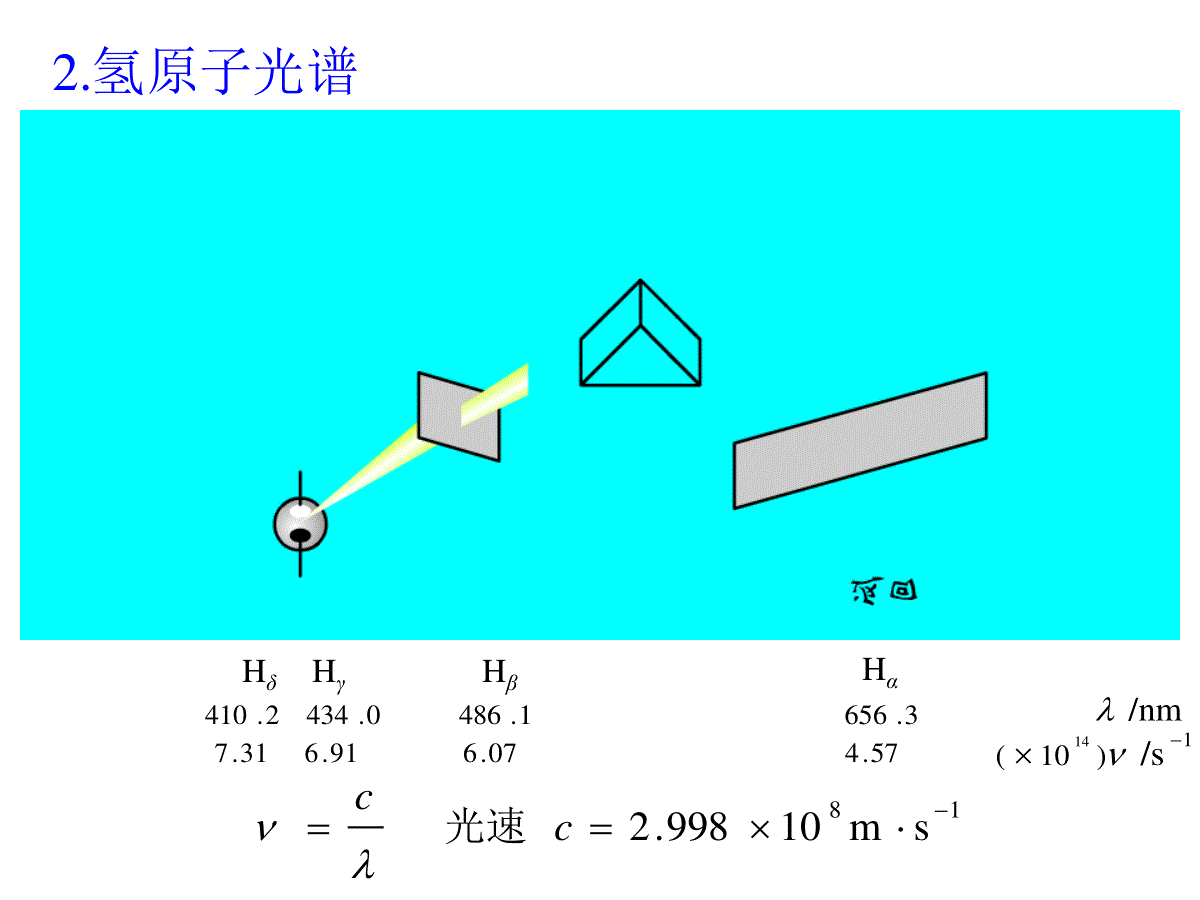
8.1氢原子结构8.2多电子原子结构8.3元素周期律第八章原子结构8.1.1氢原子光谱与Bohr理论8.1氢原子结构8.1.5氢原子的激发态8.1.4氢原子的基态8.1.3SchrÖdinger方程与量子数8.1.2电子的波粒二象性1.光和电磁辐射8.1.1氢原子光谱与Bohr理论红橙黄绿青蓝紫2.氢原子光谱18sm10998.2cc光速Hα3.65657.4Hβ1.48607.6Hγ0.43491.6Hδ2.41031.7/nm1/s)10(14•不连续光谱,即线状光谱•其频率具有一定的规律12215s)121(10289.3nvn=3,4,5,6式中2,n,3.289×1015各代表什么意义?经验公式:氢原子光谱特征:3.Bohr理论三点假设:①核外电子只能在有确定半径和能量的轨道上运动,且不辐射能量;②通常,电子处在离核最近的轨道上,能量最低——基态;原子获得能量后,电子被激发到高能量轨道上,原子处于激发态;③从激发态回到基态释放光能,光的频率取决于轨道间的能量差。hEEEEh1212E:轨道能量h:Planck常数12215s)121(10289.3nvn=3红(Hα)n=4青(Hβ)n=5蓝紫(Hγ)n=6紫(Hδ)Balmer线系原子能级Balmer线系1-222115s)11(10289.3nnv12nnhvERH:Rydberg常数,其值为2.179×10-18J。)11(2221HnnREJ)11(102.179222118-nn1-22211534s)11(10289.3sJ10626.6nn)11(2221HnnRE常数的商。电离能除以可见该常数的意义是:Planckh181510179.210289.3)111(10289.32215hE。这就是氢原子的电离能,时,,当J10179.211821Enn借助于氢原子光谱的能量关系式可定出氢原子各能级的能量:)11(122221HEEEnnREJ2HnREnJ1042.2313192H33REn,J1045.5212192H22REn,J10179.2111182H11REn,当0122EEEn,,则令1924年,LouisdeBroglie认为:质量为m,运动速度为υ的粒子,相应的波长为:8.1.2电子的波粒二象性1927年,Davissson和Germer应用Ni晶体进行电子衍射实验,证实电子具有波动性。λ=h/mυ=h/p,h=6.626×10-34J·s,Plank常量。ΨVEhmzΨyΨxΨ22222222π81.SchrÖdinger方程8.1.3SchrÖdinger方程与量子数:空间直角坐标zyx,,常数:Planckh:势能V:能量E波函数:Ψ:质量m直角坐标(x,y,z)与球坐标(r,θ,φ)的转换222zyxrcosrzqsinsinryqcossinrxqq,,,,rΨzyxΨq,YrR2.四个量子数①主量子数n1,...2,1,0nl③磁量子数m④自旋量子数ms,21smllm......,0,......21sm②角量子数n=1,2,3,……•与电子能量有关,对于氢原子,电子能量唯一决定于n;J10179.2218nE•不同的n值,对应于不同的电子层:主量子数n:12345…KLMNO…角量子数l:l的取值0,1,2,3……n-1对应着s,p,d,f…...(亚层)l决定了ψ的角度函数的形状。磁量子数m:m可取0,±1,±2……±l;其值决定了ψ角度函数的空间取向。n,l,m一定,轨道也确定0123…轨道spdf…例如:n=2,l=0,m=0,2sn=3,l=1,m=0,3pzn=3,l=2,m=0,3dz2思考题:当n为3时,l,m分别可以取何值?轨道的名称怎样?1.总能量2.波函数J10179.2J10179.2181218sEnE0/3041,,arearΨpq,,,YrRrΨqjq角度部分:41,Ypq0/3012arearR径向部分:8.1.4氢原子的基态120/30arearR径向部分半径Bohrr30120aR0rpm9.520a0Rπ41,jqYjq,,1rΨs是一种球形对称分布角度部分xzy3.波函数的物理意义Ψ2:原子核外出现电子的概率密度。电子云是电子出现概率密度的形象化描述。1s(b)1s)a(2界面图电子云的图及电子云的r2π4r22π4r径向分布函数D(r):d2概率rrdπ4d2rrdπ422概率d空间微体积22π4)(rrD令:试问D(r)与ψ2的图形有何区别?1.2s态:n=2,l=0,m=0J105448.0-210179.2-15-218-2sE4π1)-2(8102/-0302sareara0/-030)-2(π2141areara8.1.5氢原子的激发态图及电子云的2s)a(2r分布函数图轨道的径向2s(b)节面峰数=n-l2.2p态:n=2,l=1,m=+1,0,-1)0(p2mz为例以qqcosπ43)(Y02/-02/30)()1(621)(areararR其中qcos)(π214102/-030p2arearazqqqcosAcosπ43),(Yx,yz+-30°60°θ10.8660.50-0.5-1A0.866A0.5A0-0.5A-Ao0o30o60o90o120qqcoso180zY2pyY2pxyzxY2pxyz22pxYxyzxyz2p2yYxyz2p2zYxyzzY2p3.3d态:n=3,l=2,m=0,2,12d3zxyzyzd3xyzxzd3xyzxyd3xyz22d3yxxyz小结:量子数与电子云的关系•n:决定电子云的大小•l:描述电子云的形状•m:描述电子云的伸展方向8.2.1多电子原子轨道能级8.2多电子原子结构8.2.2核外电子排布轨道:与氢原子类似,其电子运动状态可描述为1s,2s,2px,2py,2pz,3s…能量:与氢原子不同,能量不仅与n有关,也与l有关;在外加场的作用下,还与m有关。8.2.1多电子原子轨道能级1.Pauling近似能级图2.Cotton原子轨道能级图•n相同的氢原子轨道的简并性。•原子轨道的能量随原子序数的增大而降低。•随着原子序数的增大,原子轨道产生能级交错现象。3.屏蔽效应+2e-e-He+2e-He+2-σe-假想He由核外电子云抵消一些核电荷的作用。屏蔽效应:J)(10179.22218nZEσ为屏蔽常数,可用Slater经验规则算得。Z-σ=Z*,Z*——有效核电荷数进入原子内部空间,受到核的较强的吸引作用。2s,2p轨道的径向分布图3d与4s轨道的径向分布图4.钻穿效应核外电子分布三规则:•最低能量原理电子在核外排列应尽先分布在低能级轨道上,使整个原子系统能量最低。•Pauli不相容原理每个原子轨道中最多容纳两个自旋方式相反的电子。•Hund规则在n和l相同的轨道上分布的电子,将尽可能分占m值不同的轨道,且自旋平行。8.2.2核外电子排布15626224s3d3p3s2p2s1sCr24:Z•半满全满规则:当轨道处于全满、半满时,原子较稳定。Z=26Fe:1s22s22p63s23p63d64s2110626224s3d3p3s2p2s1sCu29:ZN:1s22s22p3154s3dAr原子芯称为Ar4s3dAr1108.3.1原子的电子层结构和元素周期系8.3元素周期律8.3.2元素性质的周期性8.3.1原子的电子层结构和元素周期系元素周期律:元素以及由它形成的单质和化合物的性质,随着元素的原子序数(核电荷数)的依次递增,呈现周期性的变化。元素周期表(长表):•周期号数等于电子层数。•各周期元素的数目等于相应能级组中原子轨道所能容纳的电子总数。•主族元素的族号数等于原子最外层电子数。s区—ns1-2p区—ns2np1-6d区—(n-1)d1-10ns1-2(Pd无s电子)f区—(n-2)f1-14(n-1)d0-2ns2结构分区:量子数,电子层,电子亚层之间的关系每个亚层中轨道数目135726101428182n2每个亚层最多容纳电子数每个电子层最多容纳的电子数主量子数n1234电子层KLMN角量子数l0123电子亚层spdf1.有效核电荷Z*元素原子序数增加时,原子的有效核电荷Z*呈现周期性的变化。同一周期:短周期:从左到右,Z*显著增加。长周期:从左到右,前半部分有Z*增加不多,后半部分显著增加。同一族:从上到下,Z*增加,但不显著。8.3.2元素性质的周期性2.原子半径(r)•共价半径•vanderWaals半径主族元素:从左到右r减小;从上到下r增大。过渡元素:从左到右r缓慢减小;从上到下r略有增大。•金属半径主族元素125132145161r/pmCrVTiSc第四周期元素元素的原子半径变化趋势137143159173r/pmWTaHfLu第六周期元素146143160181r/pmMoNbZrY第五周期元素镧系元素从左到右,原子半径减小幅度更小,这是由于新增加的电子填入外数第三层上,对外层电子的屏蔽效应更大,外层电子所受到的Z*增加的影响更小。镧系元素从镧到镱整个系列的原子半径减小不明显的现象称为镧系收缩。3.电离能11molkJ2.520)g(LieLi(g)I基态气体原子失去电子成为带一个正电荷的气态正离子所需要的能量称为第一电离能,用I1表示。由+1价气态正离子失去电子成为带+2价气态正离子所需要的能量称为第二电离能,用I2表示。E+(g)E2+(g)+e-I2E(g)E+(g)+e-I1例如:1332molkJ11815)g(Lie(g)LiI122molkJ1.7298)g(Lie(g)LiI:加呈现出周期性变化电离能随原子序数的增N、P、As、Sb、Be、Mg电离能较大——半满,全满。同一主族:从上到下,最外层电子数相同;Z*增加不多,r增大为主要因素,核对外层电子引力依次减弱,电子易失去,I依次变小。同一周期:主族元素从ⅠA到卤素,Z*增大,r减小,I增大。其中ⅠA的I1最小,稀有气体的I1最大;长周期中部(过渡元素),电子依次加到次外层,Z*增加不多,r减小缓慢,I略有增加。4.电子亲和能元素的气态原子在基态时获得一个电子成为一价气态负离子所放出的能量称为电子亲和能。当负一价离子再获得电子时要克服负电荷之间的排斥力,因此要吸收能量。O(g)+e-O-(g)A1=-140.0kJ.mol-1O-(g)+e-O2-(g)A2=844.2kJ.mol-1电子亲和能的大小变化的周期性规律如下图:例如:同一周期:从左到右,Z*增大,r减小,最外层电子数依次增多,趋向于结合电子形成8电子结构,A的负值增大。卤素的A呈现最大负值,ⅡA为正值,稀有气体的A为最大正值。同一主族:从上到下,规律不很明显,大部分的A负值变小。特例:A(N)为正值,是p区元素中除稀有气体外唯一的正值。A的最大负值不出现在F原子而是Cl原子。原子在分子中吸引电子的能力称为元素的电负性,用表示。P电负性标度不同,数据不同,但在周期系中变化规律是一致的。电负性可以综合衡量各种元素的金属性和非金属性。同一周期从左到右电负性依次增大;同一主族从上到下电负性依次变小,F元素为3.98,非金属性最强。MPAR电负性的标度有多种,常见的有Mulliken标度(),Pauling标度()和Allred-Rochow标度()。5.电负性电负性()变化P



 三七文档所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。
三七文档所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。
本文标题:高中化学竞赛辅导课件-第八章-原子结构
链接地址:https://www.777doc.com/doc-4378850 .html