当前位置:首页 > 临时分类 > (江苏专用版)2020版高考化学总复习 专题四 第1讲 原子结构课件
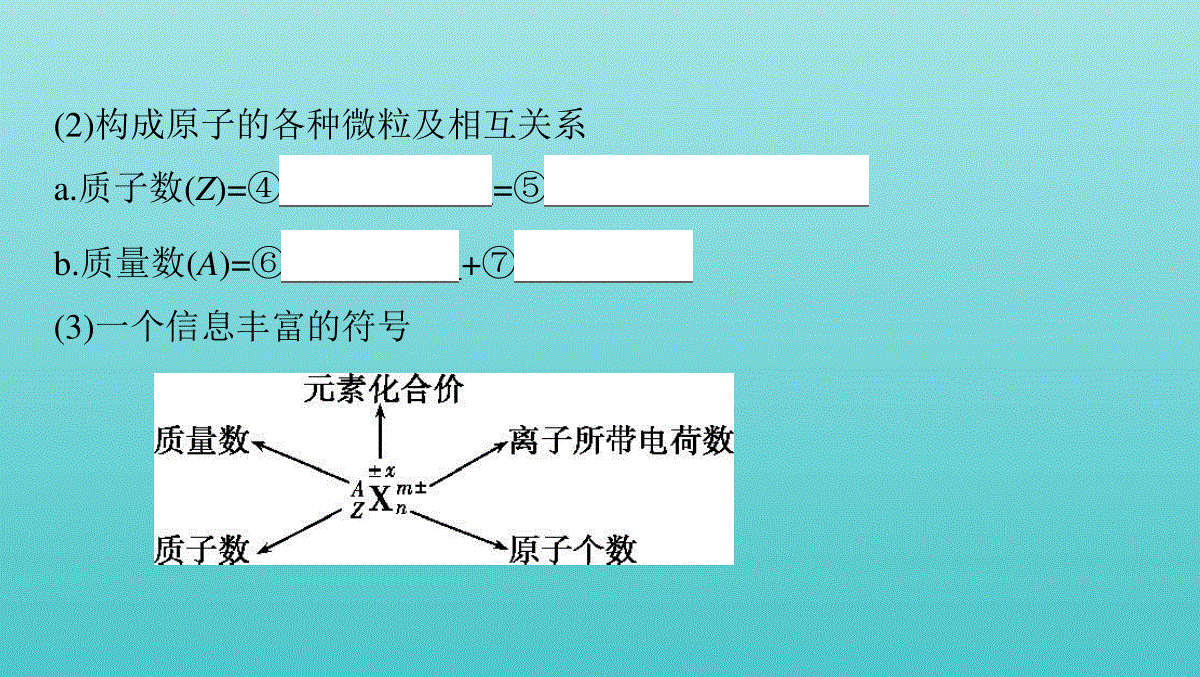
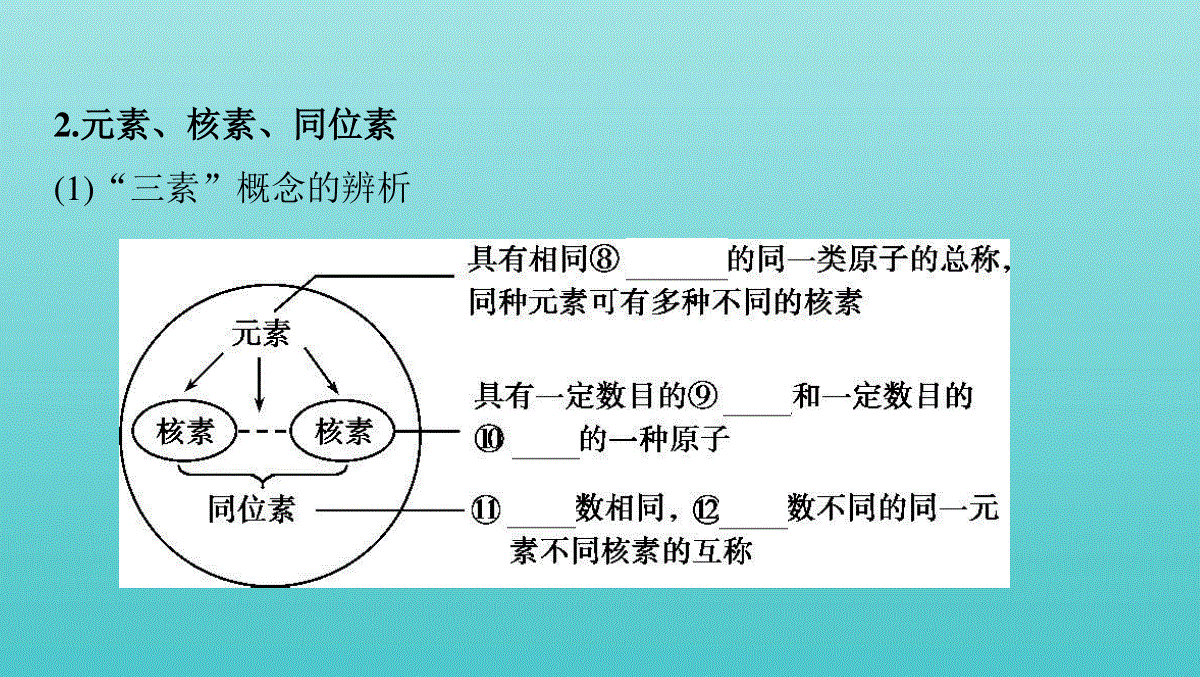
第1讲原子结构考点原子结构核外电子排布与元素推断总纲目录高考演练考点原子结构核外电子排布与元素推断1.原子结构(1)原子的构成 (2)构成原子的各种微粒及相互关系a.质子数(Z)=④核电荷数=⑤原子核外电子数b.质量数(A)=⑥质子数+⑦中子数(3)一个信息丰富的符号 2.元素、核素、同位素(1)“三素”概念的辨析 (2)同位素的“六同三不同”3.核外电子排布与排布规律序依次排布在能量逐渐升高的电子层里。(2)分层排布原则a.每层最多容纳的电子数为 2n2个。b.最外层不超过 8个(K层为最外层时不超过2个)。c.次外层不超过 18个,倒数第三层不超过 32个。(1)能量最低原则核外电子总是先排布在能量最低的电子层里,然后再按照由里向外的顺4.原子或离子结构示意图5.核外电子排布与元素性质的关系(1)金属元素原子的最外层电子数一般小于4,较易 失去电子,形成阳离子,表现出 还原性,在化合物中显正化合价。(2)非金属元素原子的最外层电子数一般大于或等于4,较易 得到电子,活泼非金属原子易形成阴离子。在化合物中主要显负化合价。(3)稀有气体元素的原子最外层为8电子(氦为2电子)稳定结构,不易失去或得到电子,通常表现为0价。1.【易错辨析】判断正误,正确的画“√”,错误的画“✕”。(1)3H核内质子数为2。 (✕)(2)37Cl原子核内中子数为20。 (√)(3)2H+核外电子数为2。 (✕)(4)13C和15N核内中子数相同。 (✕)(5)1 O的摩尔质量为18g·mol-1。 (✕)182H(6)最外层电子数相同的微粒有相似的化学性质。 (✕)(7)短周期中元素原子的最外层电子数与其电子层数相等的元素有2种。 (✕)(8)最外层只有一个或两个电子的原子一定是活泼金属元素的原子。 (✕)2.【多维思考】(1)有5种单核粒子,它们分别是 (“”内(“”元素符号未写出),则它们所属元素的种类有种。(2)1H、2H、3H三种微粒都属于,因为它们是具有相同的同一类原子。(3)在 H H H C C C N N中,核素、元素的种数分别为种、种。(4 C C C互为,因为它们是具有11 21、31、126、136、146、147、157、126)136、146、的同一元素的不同原子,它们的化学性质几乎完全相同。(5)最外层电子数是次外层电子数3倍的元素是。(6)次外层电子数是最外层电子数2倍的元素有。(7)内层电子总数是最外层电子数2倍的元素有。(8)电子层数与最外层电子数相等的元素有。(9)最外层电子数是电子层数2倍的元素有。(10)最外层电子数是电子层数3倍的元素是。答案(1)3(2)氢元素核电荷数(或质子数)(3)83(4)同位素相同的质子数和不同的中子数(5)O(6)Li、Si(7)Li、P(8)H、Be、Al(9)He、C、S(10)O题组一元素、核素、同位素、质量数、元素相对原子质量1.某元素的一种核素X的质量数为A,含N个中子,它可与1H原子构成HmX分子,在agHmX中所含质子的物质的量是 (A)A. (A-N+m)molB. (A-N)molC. (A-N)molD. (A-N+m)molaAmaAaAmaA解析X原子的质子数为(A-N),一个HmX分子中所含的质子数为(A-N+m),HmX的摩尔质量为(A+m)g·mol-1,所以agHmX中所含质子的物质的量为 (A-N+m)mol。aAm2.虾皮是食物中的“天然钙片”,这里所说的“钙”应理解为 (A)A.钙元素B.钙单质C.钙离子D.钙原子解析虾皮是食物中的“天然钙片”,其中含钙丰富,是日常饮食中钙的较好来源,这里的钙是指钙元素。3.(2018姜堰期中)下列各组粒子中,互为同位素的是 (B)A.H2O和D2OB.16O和18OC.H2和D2D.24Mg和23Na解析A项,H2O和D2O都是由氢、氧元素组成的,不同水分子,结构相同,为同一物质,错误;B项,16O和18O是氧元素的不同核素,互为同位素,正确;C项,H2和D2都是由氢元素组成的,它们互为同素异形体,错误;D项,24Mg和23Na是不同元素的原子,错误。方法技巧元素、核素、同位素之间的关系4.3He可以作为核聚变材料。下列关于3He的叙述正确的是 (C)A.3He和3H互为同位素B.3He原子核内质子数为3C.3He原子核内中子数为1D.3He原子易失去两个电子解析A项,3He和3H属于不同元素的原子,不能互称为同位素,错误;B项,3He的原子序数是2,质子数是2,错误;C项,3He原子核内中子数为3-2=1,正确;D项,当K层是最外层时,2个电子是稳定结构,3He原子达到了稳定结构,不易失去电子,错误。5.放射性元素碘-131 I)和铯-137 Cs)是核反应物中的主要元素。下列叙述正确的是 (B)A I与 I的所有性质都相同B Cs原子中含有的中子数比质子数多27C Cs与 I的中子数相同D I与 I是同素异形体13153(13755(13753.13153 13755.13755.13153 13753.13755 解析 I与 I的物理性质不同,化学性质相似,A项错误 Cs原子中含有的中子数比质子数多137-55-55=27,B项正确 Cs与 I的中子数不相同,分别是137-55=82、131-53=78,C项错误 I与 I的质子数相同,中子数不同,互为同位素,D项错误。13753 13153 13755;13755;13153 13753;13153 误区警示对元素、同位素、核素概念理解的易错点(1)一种元素可以有多种核素,也可能只有一种核素。(2)元素有多少种核素,该元素就有多少种原子。(3)同位素:“位”即核素的位置相同,在元素周期表中占同一个位置。(4)不同的核素可能具有相同的质子数,如 H与 H;也可能具有相同的中子数,如 C与 O;也可能具有相同的质量数,如 C与 N;也可能质子数、中子数、质量数均不相同,如 H与 C。(5)1H2和2H2既不是同位素,也不是同素异形体。11 31 146 168 146 147 11 126 题组二核外电子排布与元素推断6.(2019南京模拟)下列叙述中能肯定说明金属A比金属B的活动性强的是 (D)A.A原子最外层电子数比B原子的最外层电子数少B.A原子电子层数比B原子的电子层数多C.1molA从酸中置换生成的H2比1molB从酸中置换生成的H2多D.常温时,A能从酸中置换出H2,而B不能解析A项,A原子最外层电子数比B原子的最外层电子数少不能说明A的金属性强于B,如Ca的金属活动性强于Li,错误;B项,A原子电子层数比B原子的电子层数多不能说明A的金属性强于B,如Mg的金属活动性强于Cu,错误;C项,1molA从酸中置换生成的H2比1molB从酸中置换生成的H2多不能说明A的金属性强于B,如Mg的金属活动性强于Al,错误;D项,常温时,A能从酸中置换出H2,而B不能,说明A易失电子、B不易失电子,所以A的金属活动性强于B,正确。特别提醒(1)应用核外电子排布规律的注意事项核外电子排布的几条规律之间既相互独立又相互统一,不能孤立地应用其中一条。例如:当M层不是最外层时,最多排布的电子数为2×32=18个;而当它是最外层时,则最多只能排布8个电子。(2)利用稀有气体的原子结构推断元素的周期序数稀有气体原子的电子层结构与同周期的非金属元素形成的阴离子的电子层结构相同,与下一周期主族的金属元素形成的阳离子的电子层结构相同。7.短周期主族元素X、Y、Z、W的原子序数依次增大。X、Y、Z、W原子的最外层电子数之和为18,X原子的最外层电子数是其内层电子数的2倍,Y是地壳中含量最高的元素,Z2+与Y2-具有相同的电子层结构。下列说法正确的是 (D)A.单质的沸点:YZB.X、Y、Z三种元素不可能形成离子化合物C.X的最高价氧化物对应的水化物的酸性比W的强D.Y分别与Z、W形成的化合物中化学键类型不相同解析X元素的原子最外层电子数是其内层电子数的2倍,则X为碳元素,Y是地壳中含量最高的元素,则Y为氧元素,Z2+与Y2-具有相同的电子层结构,则Z为镁元素;X、Y、Z、W原子的最外层电子数之和为18,则W为硫元素。氧气常温下为气态,镁单质常温下呈固态,单质的沸点:O2Mg,即YZ,A错误;C、O、Mg三种元素可形成碳酸镁,碳酸镁为离子化合物,B错误;非金属性:CS,则酸性:H2CO3H2SO4,C错误;氧化镁中的化学键为离子键,二氧化硫、三氧化硫中的化学键为共价键,化学键类型不相同,D正确。高考演练1.(2016江苏单科,4,2分)短周期主族元素X、Y、Z、W原子序数依次增大,X原子的最外层有6个电子,Y是迄今发现的非金属性最强的元素,在周期表中Z位于ⅠA族,W与X属于同一主族。下列说法正确的是()A.元素X、W的简单阴离子具有相同的电子层结构B.由Y、Z两种元素组成的化合物是离子化合物C.W的简单气态氢化物的热稳定性比Y的强D.原子半径:r(X)r(Y)r(Z)r(W)答案B由题意可知X为O,Y为F,Z为Na,W为S。A项,X、W的简单阴离子分别为O2-、S2-,二者电子层结构不同,故错误;B项,由F、Na两种元素组成的化合物是离子化合物,故正确;C项,H2S的热稳定性比HF的弱,故错误;D项,原子半径:r(Na)r(S)r(O)r(F),故错误。2.(2015江苏单科,5,2分)短周期主族元素X、Y、Z、W原子序数依次增大,X原子最外层有6个电子,Y是至今发现的非金属性最强的元素,Z在周期表中处于周期序数等于族序数的位置,W的单质广泛用作半导体材料。下列叙述正确的是 (A)A.原子最外层电子数由多到少的顺序:Y、X、W、ZB.原子半径由大到小的顺序:W、Z、Y、XC.元素非金属性由强到弱的顺序:Z、W、XD.简单气态氢化物的稳定性由强到弱的顺序:X、Y、W解析根据题意可知,X、Y、Z、W分别为O、F、Al、Si。B项,原子半径大小顺序应为:AlSiOF;C项,元素非金属性由强到弱顺序应为:OSiAl;D项,简单气态氢化物的稳定性由强到弱顺序为:FOSi。3.(2015江苏单科,2,2分)下列有关氯元素及其化合物的表示正确的是 (C)A.质子数为17、中子数为20的氯原子 ClB.氯离子(Cl-)的结构示意图: C.氯分子的电子式:D.氯乙烯分子的结构简式:H3C—CH2Cl2017:解析A项,元素符号的左上角应为质量数,该氯原子应表示为 Cl;B项,氯原子的结构示意图为 ;D项,氯乙烯分子的结构简式为。3717 4.(2014江苏单科,2,2分)下列有关化学用语表示正确的是 (B)A.过氧化钠的电子式:B.质子数为35、中子数为45的溴原子 BrC.硫离子的结构示意图: D.间二甲苯的结构简式: 8035:解析过氧化钠的电子式为,A项错误;S2-的结构示意图为 ,C项错误;间二甲苯的结构简式为 ,D项错误。



 三七文档所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。
三七文档所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。
 zengyq12
zengyq12
共128篇文档
格式: pptx
大小: 3.0 MB
时间: 2021-04-22
本文标题:(江苏专用版)2020版高考化学总复习 专题四 第1讲 原子结构课件
链接地址:https://www.777doc.com/doc-8136219 .html