当前位置:首页 > 高等教育 > 理学 > 年高考化学第二轮热点专题训练化学反应速率(五年高考真题精练)
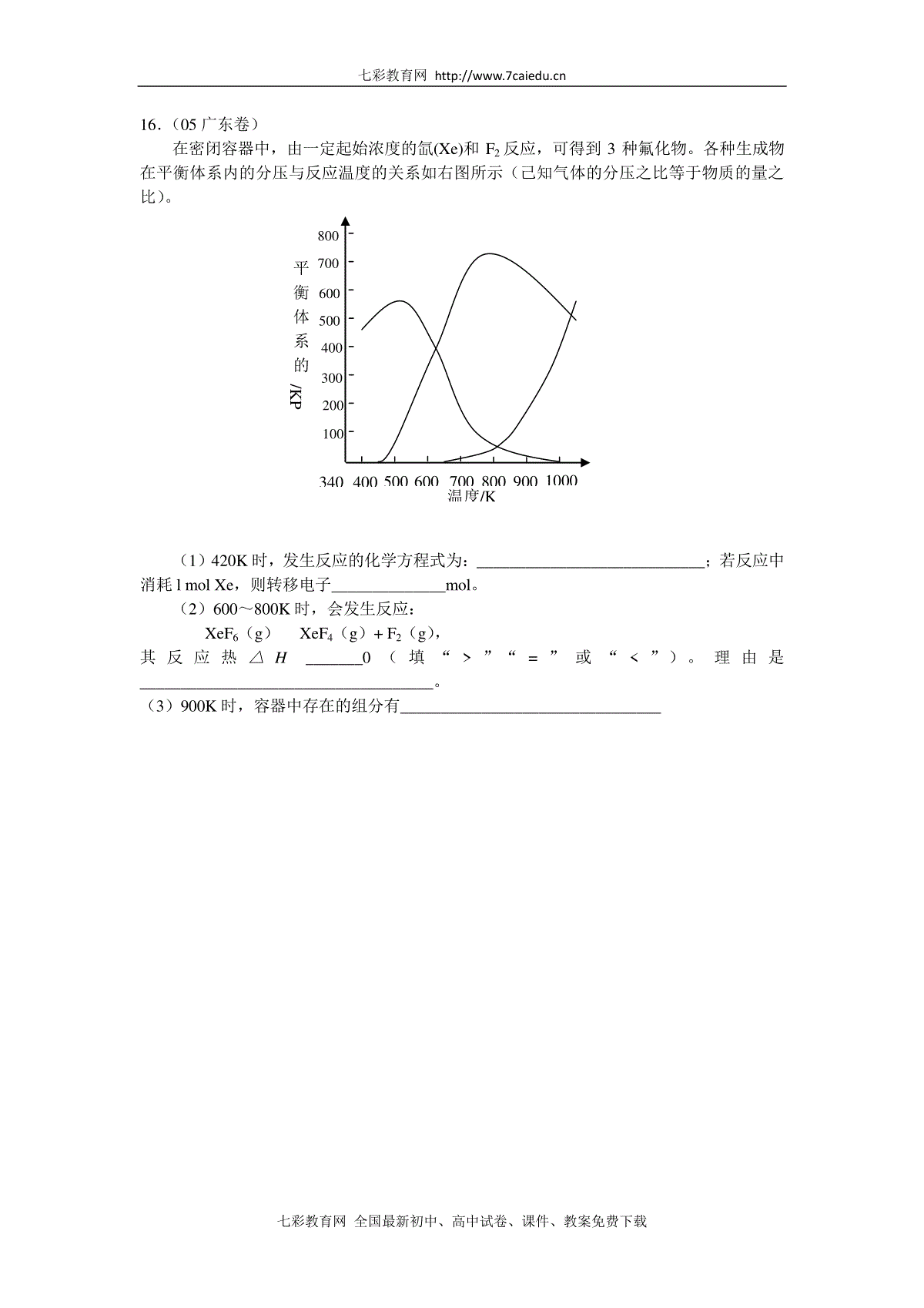
七彩教育网七彩教育网全国最新初中、高中试卷、课件、教案免费下载本资料来源于《七彩教育网》—化学反应速率(五年高考真题精练)【高考考点】化学反应速率的概念与影响因素1.(08上海卷)等质量的铁与过量的盐酸在不同的实验条件下进行反应,测定在不同时间t产生气体体积V的数据,根据数据绘制得到图1,则曲线a、b、c、d所对应的实验组别可能是()A.4-3-2-1B.1-2-3-4C.3-4-2-1D.1-2-4-32.(08广东卷)对于反应2SO2(g)+O2(g)2SO3(g),能增大正反应速率的措施是()A.通入大量O2B.增大窗口容积C.移去部分SO3D.降低体系温度3.(08北京卷)工业上制备纯硅反应的热化学方程式如下:SiCl4(g)+2H2(g)===Si(s)+4HCl(g);△H=+QkJ·mol-1(Q>0)某温度、压强下,将一定量的反应物通入密闭容器进行以上的反应(此条件下为可逆反应),下列叙述正确的是()A.反应过程中,若增大压强能提高SiCl4的转化率B.若反应开始时SiCl4为1mol,则达到平衡时,吸收热量为QkJC.反应至4min时,若HCl的浓度为0.12mol·L-1,则H2的反应速率为0.03mol/(L·min)D.当反应吸收热量为0.025QkJ时,生成的HCl通入100mL1mol·L-1的NaOH恰好反应4.(07广东卷)把铝条放入盛有过量稀盐酸的试管中,不影响...氢气产生速率的因素是()A.盐酸的浓度B.铝条的表面积C.溶液的温度D.加少量Na2SO45.(07北京卷)一定条件下,在体积为10L的密闭容器中,1molX和1molY进行反应:2X(g)+Y(g)Z(g),经60s达到平衡,生成0.3molZ,下列说法正确的是()A.以X浓度变化表示的反应速率为0.001mol/(L·s)B.将容器体积变为20L,Z的平衡浓度变为原来的1/2C.若增大压强,则物质Y的转化率减小D.若升高温度,X的体积分数增大,则该反应的H>0七彩教育网七彩教育网全国最新初中、高中试卷、课件、教案免费下载6.(06四川卷)一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如下图所示:下列描述正确的是()A.反应开始到10s,用Z表示的平均反应速率为0.158mol/(L·s)B.反应开始到10s,X的物质的量浓度减少了0.79mol/LC.反应开始到10s时,Y的转化率为79.0%D.反应的化学方程式为:X(g)+Y(g)Z(g)7.(05广东卷)对可逆反应4NH3(g)+5O2(g)4NO(g)+6H2O(g),下列叙述正确的是()A、达到化学平稳时,4υ正(O2)=5υ逆(NO)B、若单位时间内生成xmolNO的同时,消耗xmolNH3,则反应达到平稳状态C、达到化学平稳时,若增加容器体积,则正反应速率减少,逆反应速率增大D、化学反应速率关系是:2υ正(NH3)=3υ正(H2O)8.(05天津卷)在密闭容器中,在一定条件下,进行下列反应:NO(g)+CO(g)1/2N2(g)+CO2(g);△H=-373.2KJ/mol,达到平衡后,为提高该反应的速率和NO的转化率,采取的正确措施是()A.加催化剂同时升高温度B.加催化剂同时增大压强C.升高温度同时充入N2D.降低温度同时增大压强9.(04全国卷)反应2SO2+O22SO3经一段时间后,SO3的浓度增加了0.4mol·L-1,在这段时间内用O2表示的反应速率为0.04mol·L-1·s-1,则这段时间为()A.0.1sB.2.5sC.5sD.10s10.(04上海卷)将ag块状碳酸钙跟足量盐酸反应,反应物损失的质量随时间的变化曲线如下图的实线所示。在相同的条件下,将bg(a>b)粉末状碳酸钙与同浓度盐酸反应,则相应的曲线(图中虚线所示)正确的是()11.(04全国卷)在恒温恒容条件下,能使A(g)+B(g)C(g)+D(g)正反应速率增大的措施是()A.减小C或D的浓度B.增大D的浓度七彩教育网七彩教育网全国最新初中、高中试卷、课件、教案免费下载C.减小B的浓度D.增大A或B的浓度12.(08重庆卷)N2O2—是一种新型硝化剂,其性质和制备受到人们的关注.(1)N2O5与苯发生硝化反应生成的硝基苯的结构简式是。(2)2N2O5(g)→4NO2(g)+O2(g);ΔH>0①反应达平衡后,若再通入一定量氮气,则N2O5的转化率将(填“增大”、“减小”、“不变”)。②下表为反应在T1温度下的部分实验数据:t/s05001000e(N2O5)/mol·L-15.003.522.48则500s内N2O5的分解速率为。③在T3温度下,反应1000s时测得NO2的浓度为4.98mol·L-1,则T2T1。(3)如图所示装置可用于制备N2O5,则N2O5在电解池的区生成,其电极反应式为。13.(07广东卷)“碘钟”实验中,3I-+282OS=I3-+2SO42-的反应速率可以用I3-与加入的淀粉溶液显蓝色的时间t来度量,t越小,反应速率越大。某探究性学习小组在20℃进行实验,得到的数据如下表:实验编号①②③④⑤c(I-)/mol·L-10.0400.0800.0800.1600.120c(282OS)/mol·L-10.0400.0400.0800.0200.040t/s88.044.022.044.0t1回答下列问题:(1)该实验的目的是___________________________________________________。(2)显色时间t1=______________。(3)温度对该反应的反应速率的影响符合一般规律,若在40℃下进行编号③对应浓度的实验,显色时间t2的范围为______(填字母)。(A)<22.0s(B)22.0s~44.0s(C)>44.0s(D)数据不足,无法判断(4)通过分析比较上表数据,得到的结论是_________________________________________。七彩教育网七彩教育网全国最新初中、高中试卷、课件、教案免费下载14.(07海南卷)下表是稀硫酸与某金属反应的实验数据:实验序号金属质量/g金属状态c(H2SO4)/mol·L-1V(H2SO4)/mL溶液温度/℃金属消失的时间/s反应前反应后10.10丝0.550203450020.10粉末0.55020355030.10丝0.750203625040.10丝0.850203520050.10粉末0.85020362560.10丝1.050203512570.10丝1.05035505080.10丝1.150203410090.10丝1.150204440分析上述数据,回答下列问题:(1)实验4和5表明,________________________对反应速率有影响,________________反应速率越快,能表明同一规律的实验还有_________(填实验序号);(2)仅表明反应物浓度对反应速率产生影响的实验有__________________________(填实验序号);(3)本实验中影响反应速率的其他因素还有_____________________,其实验序号是___________。(4)实验中的所有反应,反应前后溶液的温度变化值(约15℃)相近,推测其原因:______________________________________________________________________________________。15.(05上海卷)在某一容积为2L的密闭容器内,加入0.8mol的H2和0.6mol的I2,在一定的条件下发生如下反应:H2(g)+I2(g)⇌2HI(g)+Q(Q0)反应中各物质的浓度随时间变化情况如图1:(1)该反应的化学平衡常数表达式为。(2)根据图1数据,反应开始至达到平衡时,平均速率v(HI)为。(3)反应达到平衡后,第8分钟时:①若升高温度,化学平衡常数K(填写增大、减小或不变)HI浓度的变化正确的是(用图2中a-c的编号回答)②若加入I2,H2浓度的变化正确的是,(用图2中d-f的编号回答)(4)反应达到平衡后,第8分钟时,若反容器的容积扩大一倍,请在图3中画出8分钟后HI浓度的变化情况七彩教育网七彩教育网全国最新初中、高中试卷、课件、教案免费下载16.(05广东卷)在密闭容器中,由一定起始浓度的氙(Xe)和F2反应,可得到3种氟化物。各种生成物在平衡体系内的分压与反应温度的关系如右图所示(己知气体的分压之比等于物质的量之比)。(1)420K时,发生反应的化学方程式为:____________________________;若反应中消耗lmolXe,则转移电子______________mol。(2)600~800K时,会发生反应:XeF6(g)XeF4(g)+F2(g),其反应热△H_______0(填“”“=”或“”)。理由是____________________________________。(3)900K时,容器中存在的组分有________________________________温度/K平衡体系的分压/KPa80070060050040030020010034040050060070008009001000七彩教育网七彩教育网全国最新初中、高中试卷、课件、教案免费下载参考答案1.AC2.A3.D4.D5.A6.C7.A8.B9.C10.C11.D12.解析:(2)①反应达到平衡后,通入N2,对化学平衡无影响,所以N2O5的转化率不变。②由v=△c△t=5.00mol·L-1-3.52mol·L-1500s-0s=0.00296mol·L-1·s-1。③反应的c(N2O5)=24×c(NO2)=12×4.98mol·L-1=2.475mol·L-1,剩余的c(N2O5)为2.525mol·L-1>2.48mol·L-1,说明反应速率比T1慢,即T2<T1。(3)由N2O4制取N2O5需要是去电子,所以N2O5在阳极区生成。电极反应式见答案。答案:(1)-NO2。(2)①不变②0.00296mol·L-1·s-1③“<”或“小于”(3)阴极;N2O4+2HNO3-2e-=2N2O5+2H+。13.(1)研究反应物I-与282OS的浓度对反应速率的影响。(2)29.3s。(3)A。(4)反应速率与反应物起始浓度乘积成正比(或显色时间与反应物起始浓度乘积成反比)。14.(1)固体反应物的表面积;表面积越大;1和2(或4和5)。(2)1、3、4、6、8;或2和5。(3)反应温度;6和7,8和9。(4)可能是硫酸过量,金属全反应,放出的热量相等,所以使等体积溶液的温度升高值相近。15.(1)K=c2(HI)c(H2)·c(I2)(2)0.167mol/L·min(3)①减小c②f(4)见右图16.(1)Xe+3F2===XeF6;6(2)>随着温度的升高,XeF6(g)XeF4(g)+F2(g)平衡向右移动,根据温度升高平衡向吸热反应方向移动的原理,则该反应的ΔH>0。(3)XeF6、XeF4、XeF2、Xe、F2七彩教育网七彩教育网全国最新初中、高中试卷、课件、教案免费下载本资料来源于《七彩教育网》




 三七文档所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。
三七文档所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。
本文标题:年高考化学第二轮热点专题训练化学反应速率(五年高考真题精练)
链接地址:https://www.777doc.com/doc-2492917 .html