当前位置:首页 > 商业/管理/HR > 公司方案 > 从高考试题特点看基本概念和基础理论的复习
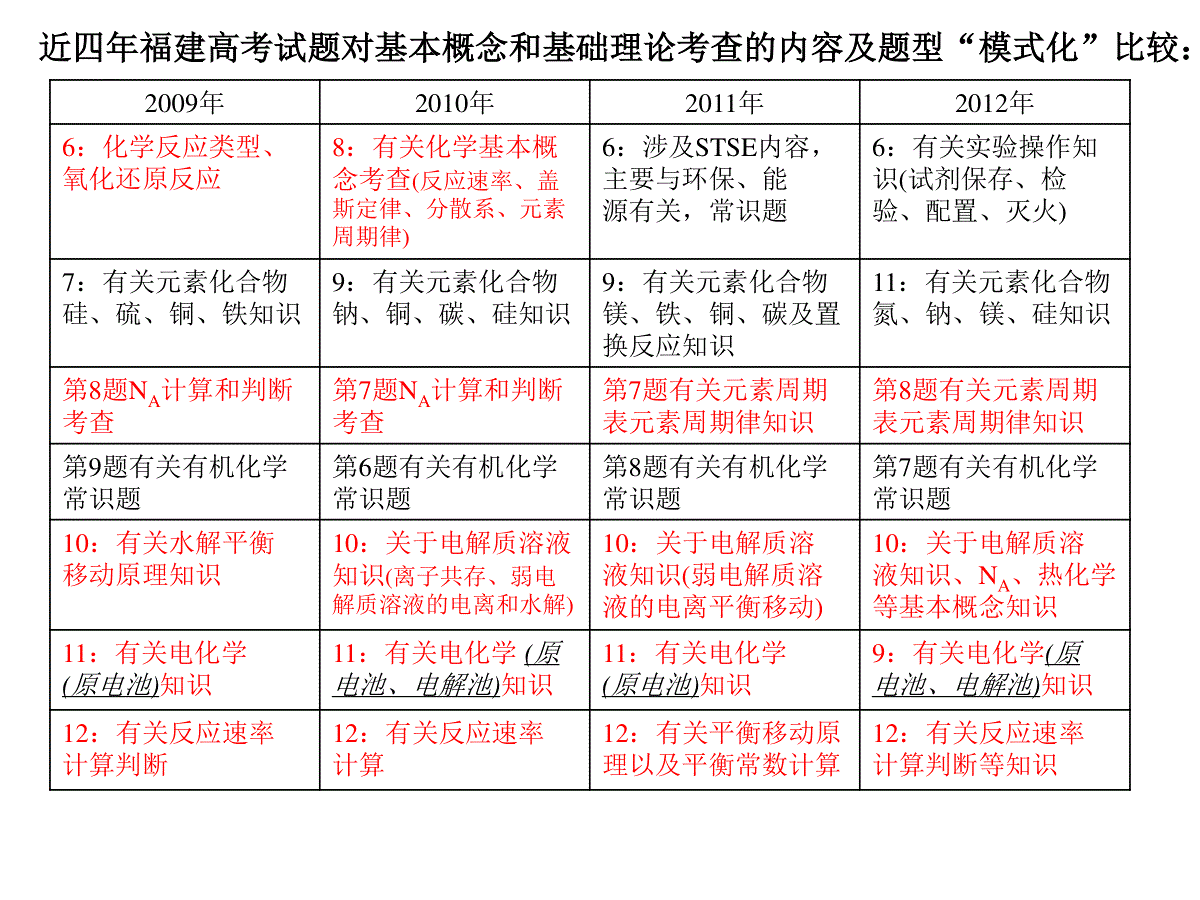
从高考试题特点看基本概念和基础理论的复习南安侨光中学陈荣聪2012.10.近四年福建高考试题对基本概念和基础理论考查的内容及题型“模式化”比较:2009年2010年2011年2012年6:化学反应类型、氧化还原反应8:有关化学基本概念考查(反应速率、盖斯定律、分散系、元素周期律)6:涉及STSE内容,主要与环保、能源有关,常识题6:有关实验操作知识(试剂保存、检验、配置、灭火)7:有关元素化合物硅、硫、铜、铁知识9:有关元素化合物钠、铜、碳、硅知识9:有关元素化合物镁、铁、铜、碳及置换反应知识11:有关元素化合物氮、钠、镁、硅知识第8题NA计算和判断考查第7题NA计算和判断考查第7题有关元素周期表元素周期律知识第8题有关元素周期表元素周期律知识第9题有关有机化学常识题第6题有关有机化学常识题第8题有关有机化学常识题第7题有关有机化学常识题10:有关水解平衡移动原理知识10:关于电解质溶液知识(离子共存、弱电解质溶液的电离和水解)10:关于电解质溶液知识(弱电解质溶液的电离平衡移动)10:关于电解质溶液知识、NA、热化学等基本概念知识11:有关电化学(原电池)知识11:有关电化学(原电池、电解池)知识11:有关电化学(原电池)知识9:有关电化学(原电池、电解池)知识12:有关反应速率计算判断12:有关反应速率计算12:有关平衡移动原理以及平衡常数计算12:有关反应速率计算判断等知识23题:涉及结构示意图、方程式书写、氧化还原反应、热化学以及周期律等知识23题:涉及结构示意图、结构简式、元素位置、方程式书写、氧化还原反应、化学平衡原理以及热化学的知识23题:涉及结构示意图、氧化还原反应的配平与电子转移计算、滴定中的计算、水解平衡原理、实验探究变量控制知识23题:涉及结构示意图、方程式书写、氧化还原反应的配平、周期律、水解平衡原理、化学平衡原理等24题:有关铝土矿中氧化铝提取的工艺流程,涉及方程式的书写、离子检验、产物推断、Ksp相关计算等24题:有关硫酸锌提取的工艺流程,涉及方程式的书写、化学式推断、混合物中含量的计算、Ksp相关计算、试剂和实验操作的选择等24题:有关TiCl4提取的工艺流程,涉及氧化还原反应知识、胶体性质、运用Ksp、Kw求算平衡常数、热化学、绿色化学、物质分离方法等24题:考查了电镀、化学镀、硫酸铜制取。涉及涉及电镀电极、氧化还原反应及电子转移计算知识、方程式的书写、化学平衡及K的计算、反应速率等25题:实验探究考查,涉及NO气体的收集、混合物中含量的计算、装置选择、误差分析等25题:实验探究考查,涉及方程式书写、离子检验、混合物含量的计算、实验操作及现象分析等25题:实验探究考查,涉及离子反应、方程式书写、物质定性检验和定量计算,实验方案、误差评价等25题:考查操作顺序、实验方案及误差分析、离子反应、中和滴定计算、沉淀溶解平衡等30题A:核外电子排布式,I1,电负性,化学键的类型,晶体类型,氢化物的稳定性和沸点,配位键的形成30题A:外围电子(价电子)排布式,电负性,化学键的类型,未成对电子数,晶体类型,等电子体,杂化轨道,配合物推断30题A:价电子排布式,I1,共价键(π键)的相关计算,杂化轨道,作用力类型判断,分子的空间构型,氢键形成条件及判断30题A:核外电子排布式,杂化轨道,作用力类型判断,晶体与熔沸点高低比较,离子的化合价推断,配位键的形成从《考试说明》对各个知识点的要求来看高考对基本概念和基础理论的考查:一、物质的组成、性质和分类(一)2012年高考考试说明:①了解分子、原子、离子等概念的含义。了解原子团的定义。②理解物理变化与化学变化的区别与联系。③理解混合物和纯净物、单质和化合物、金属和非金属的概念。④理解酸、碱、盐、氧化物的概念及其相互联系。(二)近四年福建高考的考查(略)二、化学用语及常用计量(一)2012年高考考试说明:①熟记并正确书写常见元素的名称、符号、离子符号。②熟悉常见元素的化合价。能根据化合价正确书写化学式(分子式),或根据化学式判断化合价。③了解原子结构示意图(1~18号元素)、分子式、结构式和结构简式的表示方法。④了解相对原子质量、相对分子质量的定义,并能进行有关计算。⑤理解质量守恒定律的含义。⑥能正确书写化学方程式和离子方程式,并能进行有关计算。⑦了解物质的量的单位——摩尔(mol)、摩尔质量、气体摩尔体积、物质的量浓度、阿伏加德罗常数的含义,并能进行有关物质的量的计算(混合气体的平均相对分子质量的相关计算不作要求)。(二)近四年福建高考的考查1210A:阿伏伽德罗常数的计算和判断NA(n、V、Vm、N)1007:阿伏伽德罗常数的计算和判断NA(原子数、分子数、电子转移数,n、V、Vm、N、c、Vaq)0908:阿伏伽德罗常数的计算和判断NA(质子数、电子数、弱酸的电离等,n、V、Vm、N、c、Vaq)1223(1)Na+结构示意图(2)离子方程式书写(Al3++NH3·H2O)(4)②化学方程式书写(Cu2O+浓HNO3)1224(3)化学方程式书写(Cu2(OH)2CO3+H2SO4)(3)③氧化还原的离子方程式书写及电子转移相关计算(MnO2+Fe2++H+)1123(1)P原子结构示意图(2)氧化还原反应电子转移计算(3)滴定计算(6)氧化还原反应方程式配平1125(1)离子方程式书写(Al(OH)3+OH-)(2)化学反应现象判断(NaAlO2+CO2+HCl)(3)化学方程式书写(CO2+Ba(OH)2)(6)质量分数的相关计算1023(1)Al3+结构示意图(2)结构简式(CH2=CH2)(3)化学方程式(AlCl3+H2O)(4)①化学方程式(NH3·H2O+H2O2)(5)热化学方程式书写及相关计算(盖斯定律)1024(2)氧化还原反应配平(Fe(OH)2+ClO-)(3)化学式推断(式量的相关计算)(4))Ksp、pH的相关计算(7)质量分数的相关计算1025(2)②体积分数的相关计算(4)化学方程式(C+浓硫酸)0923(1)Al原子结构示意图(3)方程式书写(S+浓硫酸)(4)方程式书写(H2O2在MnO2催化下分解)(5)化学式推断(氧化还原反应计算)(6)热化学方程式书写及相关计算(盖斯定律)0924(1)方程式(Al2O3+HCl)(2)离子方程式(SiO2+OH-)(5)Ksp、pH的相关计算三、溶液(一)2012年高考考试说明:①了解溶液的含义。②了解溶解度、饱和溶液的概念。③了解溶液的组成。理解溶液中溶质的质量分数的概念,并能进行有关计算。④了解胶体是一种常见的分散系。了解丁达尔现象。(二)近四年福建高考的考查1124(2)分散系的本质(胶体粒子的直径)1008C:分散系的区分与丁达尔现象四、物质结构和元素周期律(一)2012年高考考试说明:①了解元素、核素和同位素的含义。②了解原子构成。了解原子序数、核电荷数、质子数、中子数、核外电子数以及它们之间的相互关系。③了解原子核外电子排布规律的初步知识。④掌握元素周期律的实质。了解元素周期表(长式)的结构(周期、族)及其应用。⑤以第3周期为例,掌握同一周期内元素性质的递变规律与原子结构的关系。⑥以IA和VIIA族为例,掌握同一主族内元素性质递变规律与原子结构的关系。⑦了解金属、非金属在元素周期表中的位置及其与性质的规律。⑧了解化学键的定义。了解离子键、共价键的形成。(二)近四年福建高考的考查1208:元素周期表、周期律(氢化物的稳定性、最高价含氧酸酸性、原子半径、两性金属—N、Al、Si、S)1107:元素周期表、周期律(气态氢化物的稳定性、最高价含氧酸酸性、碱的碱性、电子层结构(原子序数))1008D:元素周期律(非金属性强弱比较与HX酸性)1223(4)①元素周期律(非金属性强弱比较——O、S)1023(1)元素周期表——Cl的位置描述0923(2)元素周期表为依托(非金属性强弱比较——C、S)五、化学反应与能量(一)2012年高考考试说明:①了解氧化还原反应的本质。了解常见的氧化还原反应。②了解化学反应中能量转化的原因,能说出常见的能量转化形式。③了解化学能与热能的相互转化。了解吸热反应、放热反应、反应热等概念。④了解热化学方程式的含义,能正确书写热化学方程式,能用盖斯定律进行有关反应热的简单计算。⑤了解能源是人类生存和社会发展的重要基础。了解化学在解决能源危机中的重要作用。⑥了解原电池和电解池的工作原理,能写出电极反应和电池反应方程式。了解常见化学电源的种类及其工作原理。⑦理解金属发生电化学腐蚀的原因,了解金属腐蚀的危害和防止金属腐蚀的措施。(二)近四年福建高考的考查1209:电化学知识——原电池、电解池串联(电极的氧化与还原、电子流向、离子移动、离子浓度的改变、电极反应)1210D:热化学——焓变与△H1111:原电池知识—(电极反应及总反应、氧化与还原、离子移动)1008B:盖斯定律与△H1011:蓄电池——电极反应式、电子转移的计算、离子移动、原电池的构成判断0906:反应的基本类型与氧化还原反应的本质0911:电化学(原电池)基础与化学平衡原理的综合考查—电极反应、化学平衡状态、平衡移动原理的应用1224(1)电镀知识(2)①氧化还原反应中氧化剂和还原剂判断1124(4)热化学方程式书写及相关计算(盖斯定律)—TiO2+C+Cl21023(5)热化学方程式书写及相关计算—CS2+O20923(6)热化学方程式书写及相关计算(盖斯定律)—Al+CO2注:热化学部分在12年中有所淡化盖斯定律的应用及热化学方程式书写的考查六、化学反应速率和化学平衡(一)2012年高考考试说明:①了解化学反应速率的概念、反应速率的定量表示方法。②了解催化剂在生产、生活和科学研究领域中的重大作用。③了解化学反应的可逆性。④了解化学平衡建立的过程。了解化学平衡常数的含义,能够利用化学平衡常数计算反应物的转化率。⑤理解外界条件(浓度、温度、压强、催化剂等)对反应速率和化学平衡的影响,认识其一般规律。⑥了解化学反应速率和化学平衡的调控在生活、生产和科学研究领域中的重要作用。1212:控制变量法研究化学反应速率——转化率计算、速率的计算及速率的影响因素(二)近四年福建高考的考查1212控制变量法研究化学反应速率(酸碱性、浓度对速率影响,转化率、速率计算)1112:平衡移动原理及平衡常数的计算(浓度、温度、固体对平衡的影响,K的计算)1008A:控制变量法研究化学反应速率1012:化学反应速率的计算0911C、D:平衡移动原理与电化学结合(平衡状态判断、浓度对平衡影响)0912:控制变量法研究化学反应速率(浓度对速率影响)1223(5):平衡移动原理及平衡常数(绝热下、压强、温度与K间的关系)1224(2)②:控制变量法研究化学反应速率(反应的停止)1224(3)④:化学平衡常数的计算1123(4):控制变量法研究化学反应速率及计算(IO3-+SO32-+H+)1124(3):中和反应平衡常数计算(利用数学关系巧妙代换—Ksp、Kw求算K)1023(4)②:平衡移动原理七、电解质溶液(一)2012年高考考试说明:①了解电解质的概念、强电解质和弱电解质的概念。②了解电解质在水溶液中的电离,以及电解质溶液的导电性。③了解弱电解质在水溶液中的电离平衡。④了解水的电离和水的离子积常数。⑤了解溶液pH的定义。能进行pH的简单计算。⑥了解盐类水解的原理、影响盐类水解程度的主要因素、盐类水解的应用(弱酸弱碱盐的水解不作要求)。⑦了解离子反应的概念、离子反应发生的条件。⑧了解难溶电解质的沉淀溶解平衡及沉淀转化的实质。*以上各部分知识的综合应用。(二)近四年福建高考的考查1210B:Kw与pH、强弱酸的中和能力1110:弱酸的电离平衡的影响因素(探究pH改变的方法)1010:离子共存、弱电解质溶液的电离与水解(OH、HCO3-,H+、NO3-、SO32-,弱酸弱碱的浓度与pH)0910:水解平衡(影响因素、K等)1223(3):水解平衡原理的应用(SO32-的水解)1224(3)②:水解平衡原理的应用(HCO




 三七文档所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。
三七文档所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。
 藤藤小妞
藤藤小妞
共140篇文档
格式: ppt
大小: 101 KB
时间: 2020-01-07
本文标题:从高考试题特点看基本概念和基础理论的复习
链接地址:https://www.777doc.com/doc-2740122 .html